
Divulgado Resultado Preliminar da 3ª etapa da Chamada Pública 010/2023
Confira aqui o resultado

Divulgados resultados da prova oral e do processo seletivo para o Mestrado do PPGVIDA
Confira o resultado

PPGVIDA divulga 4ª Republicação da Chamada Pública 009/2023
O resultado da prova oral e do processo de seleção serão divulgados na próxima segunda-feira, 11/12.

Divulgado cronograma da Prova Oral do Processo Seletivo para curso de mestrado do PPGBIO INTERAÇÃO
Confira aqui o calendário de avaliações.

Divulgado resultado final da Prova Escrita, da Chamada Pública 010/2023
Confira a lista com o resultado final da prova escrita

Divulgado Resultado de Pedido de Recurso da Prova Escrita do processo seletivo para ingresso no curso de Mestrado do PPGBIO-Interação
Confira o resultado dos pedidos de recurso

Fiocruz Amazônia divulga cronograma da Prova Oral para ingresso no Doutorado Acadêmico do PPGBIO-Interação
As provas iniciam nesta quarta-feira, 6/12.

Calendário da eleição ao cargo de diretor(a) do ILMD/Fiocruz Amazônia sofre alteração
Alteração foi necessária em virtude de um incidente de segurança da informação que levou à restrição de acesso externo ao site do ILMD/Fiocruz Amazônia

Tese de Doutorado do Daspam inova na abordagem das políticas públicas de saúde indígena e identifica fatores que impactam na gestão e assistência aos povos indígenas
Defesa foi a terceira aprovada pelo DASPAM, desde sua criação em 2020. Tese examina como as políticas de saúde indígena são efetivamente produzidas e transformadas no cotidiano institucional

Expedição do Projeto Diagnóstico Situacional das UBS Fluviais visita embarcações que atendem a zona ribeirinha de Manaus
Equipe responsável pela calha do Rio Negro realizou o trabalho nos dias 17 e 18/03, com visitas às Unidades Básicas de Saúde Fluviais Antonio Levino e Ney Larcerda, mantidas pela Secretaria Municipal de Saúde (Semsa-Manaus)

ILMD/Fiocruz Amazônia disponibiliza banco de currículo para alunos de Iniciação Científica
O prazo para cadastro no banco de currículo vai de 24/3 a 7/4.

Fiocruz Amazônia reúne em Manaus para formação do Projeto Começo Meio Começo 140 agentes comunitários de saúde de 11 municípios do Amazonas
Treinamento teve três dias de duração, encerrando-se nesta sexta-feira, 21/03, discutindo questões relacionadas à violência, injustiça, racismo ambiental e contaminação por agrotóxico e mercúrio

Aberto processo eleitoral para cargo de diretor(a) do ILMD/ Fiocruz Amazônia
A votação será realizada em turno único, no dia 28/04/2025, no horário entre as 8h e 16h.

Projeto Moetá inicia segunda fase de atuação com atividades de educação em saúde na Zona Leste de Manaus
Trailer da Saúde, unidade móvel da Fiocruz Amazônia, equipado com laboratório e utilizado de modo itinerante para atendimentos e pesquisas, fica na Casa Mamãe Margarida até sexta-feira, 21/03

Aula inaugural abre ano letivo da Fiocruz Amazônia com palestra sobre os desafios da formação em Saúde Coletiva
Com o tema “Complexidade e desafios emergentes: formação, ciência e prática da saúde”, foi dado início ao ano letivo para os cursos de mestrado e doutorado do PPGVIDA e PPGBIO-Interação

Estudo alerta para o problema da dupla carga de má nutrição em crianças de zonas remotas da Amazônia
Pesquisa acende alerta para a situação de crianças menores de cinco anos, especialmente das mais vulneráveis em contexto de crise climática, pois são esperados impactos diretos sobre o crescimento e desenvolvimento das mesmas

Abertura do ano letivo da Fiocruz Amazônia contará com aula inaugural sobre Saúde Coletiva e VI Workshop Estratégico da Educação
Aula inaugural do ano acadêmico abordará, na manhã da terça-feira,18/03, o tema “Complexidade e desafios emergentes: formação, ciência e prática da saúde coletiva”

Divulgada lista de matrículas efetivadas para no curso de Mestrado do PPGBIO-Interação 2025
As aulas terão início em março de 2025.

Fiocruz Amazônia divulga lista de alunos matriculados no curso de Doutorado do PPGBIO-Interação 2025
O curso, cujas vagas são oferecidas na presente Chamada Pública, terá sede em Manaus.

Programas de pós-graduação da Fiocruz Amazônia recebem estudantes da América Central dentro do Programa Move La América, da CAPES
Primeiros alunos a chegarem foram a enfermeira Edith Gómez Rodriguez e o psicólogo Victor Gonzales Obando, alunos de Doutorado e Mestrado da Universidade Católica da Nicarágua

Projeto identifica padrões de violência contra mulher na Amazônia
Pesquisa realiza o cruzamento inédito de mais de 90 variáveis para compreender o feminicídio e embasar o desenvolvimento de políticas públicas integradas

Fiocruz Amazônia recebe cientistas japoneses para realização de treinamento em diagnóstico do vírus Oropouche
Workshop acontecerá entre os dias 7 e 13/03, na sede da Fiocruz Amazônia, com a participação de pesquisadores da Rede Genômica da Fiocruz.

Doutorado do PPGBIO-Interação da Fiocruz Amazônia tem primeira defesa de tese marcada para o dia 14/03
Leormando Fortunato Dornelas Júnior é graduado em Ciências Biológicas e pertence à primeira turma do PPGBIO-Interação, programa criado em 2021

Fiocruz Amazônia leva curso de atualização do QualificaSUS para agentes comunitários de saúde de Autazes (AM)
VDEIC se reuniu com titular da pasta da Saúde do município, Rainer Figueiredo, com as finalidades de apresentar oficialmente o programa, que se encontra em sua fase II de execução, e definir as atribuições de cada ente

Fiocruz Amazônia divulga 2ª Republicação da Chamada Pública referente ao Doutorado do PPGBIO-Interação 2025
O curso, cujas vagas são oferecidas na presente Chamada Pública, terá sede em Manaus. As aulas terão início em março de 2025.

Fiocruz Amazônia recebe equipe de Privacidade e Proteção de Dados da Fiocruz para tratar sobre a adequação da unidade à Lei Geral de Proteção de Dados Pessoais
A LGPD é a lei brasileira que controla a privacidade e o uso/tratamento de dados pessoais, e que também altera os artigos 7º e 16º do Marco Civil da Internet.

Fiocruz Amazônia realiza acolhida aos alunos bolsistas de Iniciação Científica 2025
Este ano, programa conta com 46 estudantes da graduação superior, que terão a oportunidade de desenvolver projetos científicos sob orientação dos pesquisadores-doutores vinculados a laboratórios de pesquisa da unidade

Fiocruz Amazônia contribui para construção de plano de apoio institucional da Secretaria de Atenção Primária à Saúde do MS para o Estado do Amazonas
Apoiador Institucional para o Amazonas, da Secretaria de Atenção Primária à Saúde do MS, visitou o ILMD/Fiocruz Amazônia para iniciar as tratativas

Bolsistas de iniciação científica da Fiocruz Amazônia irão conhecer a sede da Fiocruz, no Rio de Janeiro
Os alunos irão participar ainda de um Tour para conhecer a Instituição: Parque da Ciência, Museu da Vida e o Castelo Mourisco.

Projeto Começo Meio Começo, de formação de trabalhadores da Atenção Básica dos campos, florestas e águas, inicia encontros presenciais nos territórios de oito estados da Região Norte
Facilitadores estarão atuando em 33 polos educacionais, nos Estados do Tocantins, Maranhão, Acre, Amapá, Rondônia, Roraima, Pará e Amazonas, em encontros com duração mínima de três dias

Fiocruz Amazônia oferta vagas para aluno especial em disciplinas do PPGVIDA período 2025/1
Inscrições ocorrerão até a quarta-feira, 19/02. O horário limite para envio da inscrição será 17h (horário de Manaus) do último dia de inscrição

The Lancet destaca relevância da trajetória do médico e pesquisador clinico Marcus Lacerda, especialista em malária na Amazônia
Publicação destaca importãncia dos estudos coordenados por Larcerda, sobre o uso da Tafenoquina, única terapia para a cura radical da malária causada pelo plasmodium Vivax, aprovada nos últimos 40 anos

Fiocruz Amazônia divulga 1ª Republicação da Chamada Pública referente ao Mestrado do PPGBIO-Interação 2025
Prazo para matrícula institucional dos classificados foi alterado para 21 a 27/02/2025. As aulas terão início em março/25.

Fiocruz Amazônia divulga 1ª Republicação da Chamada Pública referente ao Doutorado do PPGBIO-Interação 2025
Republicação altera cronograma de matricula institucional para o ingresso no Doutorado do PPGBIO-Interação 2025

Pesquisadoras da Fiocruz Amazônia recebem homenagem da Fapeam nas áreas de Ciências Biológicas e Ciências Exatas
Diretora da Fiocruz Amazônia, Stefanie Lopes, e a pesquisadora em Saúde Pública, Priscila Aquino, foram homenageadas em reconhecimento às mulheres pesquisadoras em atuação no Amazonas com maior número de projetos fomentados pela Fapeam entre 2019 e 2024

Fiocruz Amazônia deverá ter participação ampliada na nova etapa do Programa VigiFronteiras Brasil
Coordenadora Geral Adjunta e do Stricto Sensu da Fiocruz e coordenadora do VigiFronteiras Brasil, Eduarda Cesse, juntamente com a coordenadora acadêmica do programa, Andréa Sobral, e a coordenadora de Gestão Adélia Araújo, se reuniram na sede do ILMD/Fiocruz Amazônia para consolidar a Unidade como um Polo do Programa VigiFronteiras Brasil 2

Fiocruz Amazônia convoca para matrícula institucional os aprovados no processo seletivo para ingresso no Mestrado do PPGBIO-Interação em 2025
Matrícula acontece entre os dias 21 e 24 de fevereiro de 2025, na sede do ILMD/Fiocruz Amazônia, na Rua Teresina, 476, Adrianópolis.

Fiocruz Amazônia apresenta projetos para melhoria da Atenção Básica na Amazônia
Financiados pelo Ministério da Saúde, “Começo Meio Começo” e “Diagnóstico das Unidades Básicas de Saúde na Amazônia Legal e Pantanal” foram as iniciativas apresentadas no Encontro Nacional da Estratégia Saúde da Família Ribeirinha, no Auditório Belarmino Lins, na Assembleia Legislativa do Estado do Amazonas (ALEAM)

Fiocruz Amazônia se integra ao Projeto STEM na Saúde de equidade de gênero em ciência, tecnologia e inovação
Iniciativa visa beneficiar diretamente, meninas e mulheres, jovens estudantes, com ações de capacitação e desenvolvimento profissional nas áreas de CT&I, com foco na inclusão de mulheres em atividades científicas inovadoras

Fiocruz Amazônia ganha prêmio Ênio Candotti na categoria Pesquisador Inovador
Pesquisador da Fiocruz Amazônia Luis André Morais Mariúba coordena o Núcleo de Inovação Tecnológica (NIT) da unidade da Fiocruz em Manaus e é membro do laboratório de Diagnóstico e Controle de Doenças Infecciosas na Amazônia (DCDIA)

Fiocruz Amazônia participa de discussão sobre prioridades de investigação acerca dos vetores da febre Oropouche
Um dos focos principais do evento são os estudos acerca da biologia dos mosquitos silvestres, apontados como potenciais vetores da doença

Fiocruz Amazônia e Instituto Mamirauá entregam lanternas doadas por multinacional francesa de soluções de energia para parteiras do Amazonas
Mil lanternas recarregáveis com energia solar foram entregues à Associação das Parteiras Tradicionais do Amazonas Algodão Roxo (APTAM), em ato realizado na sede da Fiocruz Amazônia, em Manaus, com representantes de Tefé, Itacoatiara, Maraã e São Gabriel da Cachoeira

Fiocruz Amazônia atualiza e reestrutura página da Educação no website da unidade
Processo foi desenvolvido com a participação efetiva dos coordenadores dos cursos, responsáveis pela reestruturação de cada espaço referente a cada um dos programas de pós-graduação, e das esquipes técnicas que integram a Seca e o Posgrad.

Fiocruz Amazônia alerta para importância da saúde mental e realiza atividades alusivas ao Janeiro Branco para trabalhadores e trabalhadoras
Evento destacou importância do autocuidado com a saúde mental, por meio de palestras e dinâmicas de relaxamento, massoterapia e aromaterapia, tendo como foco principal o equilíbrio emocional e o bem-estar no ambiente de trabalho.

Divulgado resultado final do processo seletivo do curso de Doutorado Acadêmico do PPGBIO-Interação
Classificação final para o processo de seleção de candidatos para ingresso no primeiro semestre de 2025 do curso de Doutorado do Programa de Pós-Graduação Stricto Sensu em Biologia da Interação Patógeno Hospedeiro

Divulgado resultado definitivo da 3ª Etapa do processo seletivo para ingresso no curso de doutorado do PPGBIO-Interação
As aulas estão previstas para iniciar em 17 de março de 2025.

PPGBIO-Interação divulga resultado dos pedidos de recursos relativos à 3ª etapa do Doutorado Acadêmico
Processo de seleção para ingresso no curso de Doutorado Acadêmico do PPGBIO-Interação

PPGBIO-Interação divulga resultado definitivo da 2ª etapa do processo seletivo para ingresso no curso de doutorado
O curso, cujas vagas são oferecidas na presente Chamada Pública, terá sede em Manaus.

Divulgado o resultado dos pedidos de recursos da 2ª etapa do Processo Seletivo para ingresso no curso de doutorado do PPGBIO-Interação
Para esta Chamada Pública, estão sendo oferecidas 20 vagas

Divulgado resultado final do processo seletivo do Mestrado Acadêmico do PPGBIO-Interação
Classificação final referente ao processo seletivo do Mestrado Acadêmico para ingresso no 1º semestre de 2025

PPGBIO-Interação divulga resultado dos pedidos de recurso da 4ª Etapa do processo seletivo para ingresso em curso de mestrado
As aulas estão previstas para iniciar em 17 de março de 2025.

PPGBIO-Interação divulga resultado definitivo da 4ª Etapa do processo seletivo para ingresso em curso de mestrado
As aulas estão previstas para iniciar em 17 de março de 2025.

Projeto Moetá realiza painel de amostras para marcar encerramento das atividades em 2024 e o alcance da iniciativa
No total, foram realizadas 398 oficinas em 67 instituições de diferentes localidades e zonas de Manaus, alcançando aproximadamente 3,5 mil pessoas, a maioria estudantes da rede pública estadual com repasse de informações em saúde, atividades lúdicas, palestras e serviços de orientação e cuidados em saúde e meio ambiente

Fiocruz e Universidade de Glasgow recebem inscrições de jovens doutores até dia 26/01/2025 para participarem de evento sobre os efeitos das mudanças climáticas sobre a saúde de populações na Amazônia
Deverão ser selecionados, no total, 20 trabalhos, sendo dez vagas para pesquisadores brasileiros e dez para britânicos.

Fiocruz Amazônia divulga resultado preliminar da 4ª etapa do processo seletivo para ingresso em curso de mestrado do PPGBIO-Interação
As aulas estão previstas para iniciar em 17 de março de 2025.

PPGBIO-Interação divulga resultado final da 3ª etapa do processo seletivo para ingresso em curso de mestrado
A divulgação da classificação final da seleção ocorre no dia 23 de dezembro.

PPGBIO-Interação divulga resultado dos recursos da 3ª etapa do processo seletivo para ingresso em curso de mestrado
A divulgação da classificação final da seleção ocorre no dia 23 de dezembro. As aulas estão previstas para iniciar em 17 de março de 2025.

Projeto Ágape realiza evento de atualização em educação, saúde e cidadania para mulheres migrantes
Finalidade é aprofundar o conhecimento em relação ao acesso às políticas de assistência jurídica, educação, saúde, empregabilidade e cidadania, no âmbito do Programa Fortalece SUS

PPGBIO-Interação divulga classificação final preliminar do processo seletivo para ingresso em curso de doutorado
A divulgação da classificação final da seleção ocorre no dia 23 de dezembro.

PPGBIO-Interação divulga resultado preliminar da 3ª etapa do processo seletivo para ingresso em curso de doutorado
A divulgação da classificação final da seleção ocorre no dia 23 de dezembro.

PPGBIO-Interação divulga resultado preliminar da 3ª Etapa do processo Seletivo para curso de mestrado acadêmico
A divulgação da classificação final da seleção ocorre no dia 19 de dezembro.

Fiocruz Amazônia divulga resultado preliminar da prova oral do processo seletivo para curso de doutorado do PPGBIO-Interação
O curso, cujas vagas são oferecidas na presente Chamada Pública, terá sede em Manaus.

Projeto da Fiocruz Amazônia de vigilância alimentar e nutricional indígena realiza oficina com etnias de Novo Airão
Projeto é financiado pelo Programa Inova Fiocruz e já realizou oito de um total de 12 oficinas voltada aos profissionais de saúde (indígenas e não-indígenas), com apoio do DSEI e CONDISI/MAO

Fiocruz Amazônia divulga 2ª republicação da chamada pública Nº 011/2024
A divulgação da classificação final da seleção ocorre no dia 23 de dezembro.

PPGVIDA divulga resultado da prova oral e resultado preliminar do processo seletivo para ingresso em curso de mestrado
A divulgação do resultado final está prevista para o dia 20/12. As aulas iniciam no dia 17 de março de 2025.

Fiocruz Amazônia discute planificação da atenção à saúde na Região Amazônica
Oficina de pesquisa visa desenvolvimento de estudo que vai trabalhar a planificação da Atenção à Saúde em territórios líquidos de cinco estados, na Região Amazônica

Delegação do Instituto de Microbiologia da China visita a Fiocruz Amazônia
Finalidade foi estabelecer série de intercâmbios e colaborações acadêmicas dentro de acordo de cooperação internacional entre China e Brasil, coordenado pela Fiocruz, discutindo possibilidades de cooperação em patógenos de plantas e humanos

Ministério da Saúde e Fiocruz Amazônia farão diagnóstico das unidades básicas de saúde fluviais em funcionamento no AM, PA e AP
Projeto abrangerá 51 municípios, que deverão ser visitados por equipes do MS, Fiocruz e parceiros institucionais como a Universidade Federal do Amazonas (Ufam), Universidade Federal do Pará (UFPA). Universidade Federal do Oeste do Pará (UFOPA) e a ONG Saúde e Alegria. Um relatório parcial do estudo será apresentado na COP 30, em Belém (PA)

PPGBIO-Interação realiza II Oficina de Planejamento Estratégico e Autoavaliação com vistas ao quadriênio 2025-2029
Evento integra processo contínuo de autoavaliação proposto pela CAPES, como forma de promover o aperfeiçoamento dos programas de pós-graduação

Fiocruz Amazônia se prepara para implantar Núcleo de Saúde do Trabalhador com apoio da Coordenação de Saúde do Trabalhador da Fiocruz
Equipe multidisciplinar da Coordenação de Saúde do Trabalhador (CST) da Fundação Oswaldo Cruz esteve no ILMD/Fiocruz Amazônia para identificar possíveis espaços que possam atender a demanda de instalação do NUST, dentro do Programa de Estruturação e Ampliação da Saúde do Trabalhador nas Unidades Regionais

PPGBIO Interação divulga cronograma da 3ª Etapa do processo Seletivo para ingresso no curso de mestrado acadêmico do PPGBIO-Interação
A divulgação da classificação final da seleção ocorre no dia 19 de dezembro.

Divulgado resultado final da 2ª Etapa do processo Seletivo para curso de mestrado acadêmico do PPGBIO-Interação
As aulas estão previstas para iniciar em 17 de março de 2025.

PPGBIO-Interação divulga resultado dos recursos da 2ª Etapa do processo Seletivo para curso de mestrado acadêmico
A divulgação da classificação final da seleção ocorre no dia 19 de dezembro.

Divulgado resultado definitivo da 3ª Etapa do processo de seletivo para curso de Mestrado Acadêmico do PPGVIDA
As aulas iniciam no dia 17 de março de 2025.

Divulgado resultado dos pedidos de recursos interpostos da 3ª Etapa do processo de seletivo para curso de Mestrado Acadêmico do PPGVIDA
A divulgação do resultado final está prevista para o dia 20/12

PPGBIO-Interação divulga cronograma da 2ª Etapa do processo seletivo para ingresso no curso de doutorado
. As aulas estão previstas para iniciar em 17 de março de 2025.

PPGBIO-Interação divulga resultado da 2ª Etapa do processo Seletivo para ingresso em curso de mestrado
Ao egresso desse curso será outorgado o Diploma de Mestre em Ciências com área de concentração em Biologia da Interação Patógeno Hospedeiro.

PPGVIDA divulga resultado da 3ª etapa do processo de seleção para ingresso no curso de mestrado
A divulgação do resultado final está prevista para o dia 20/12

Fiocruz Amazônia recebe homenagem da Fapeam pelo Dia Estadual do Pesquisador Científico
Na oportunidade, foram anunciados novos editais destinados ao fortalecimento da área de Ciência, Tecnologia e Inovação no Amazonas

PPGVIDA divulga resultados dos pedidos de recursos interpostos e resultado final da prova de Saúde Coletiva da chamada pública nº 009/2024
A divulgação do resultado final está prevista para o dia 20/12. As aulas iniciam no dia 17 de março de 2025.

PPGBIO-Interação divulga inscrições homologadas do processo Seletivo para curso de doutorado
A divulgação da classificação final da seleção ocorre no dia 23 de dezembro. As aulas estão previstas para iniciar em 17 de março de 2025.

Divulgadas atas do resultado dos pedidos de recursos e resultado final da 1ª Etapa do processo Seletivo do Mestrado PPGBIO-Interação
A divulgação da classificação final da seleção ocorre no dia 19 de dezembro.

Pesquisadora da Fiocruz Amazônia apresenta pesquisas científicas sobre onças durante evento temático no zoológico do CIGS
A ação faz parte da Semana da onça-pintada, evento alusivo ao Dia Nacional da Onça-pintada, celebrado no dia 29 de novembro.

Fiocruz Amazônia divulga 1ª Republicação da Chamada Pública nº 011/2024
As inscrições se encerram nesta quinta-feira 28/11.

PPGBIO-INTERAÇÂO divulga resultado preliminar da 1ª Etapa do processo seletivo da Chamada Pública 10/2024
Processo de seleção será realizado em 4 etapas: 1ª Etapa: Homologação das inscrições; 2ª Etapa: Prova Escrita; 3ª Etapa: Prova oral – Projeto de Pesquisa e Entrevista; 4ª Etapa: Avaliação do Currículo Lattes documentado.

PPGVIDA divulga resultado da prova de Saúde Coletiva do processo seletivo para ingresso no curso de mestrado
A divulgação do resultado final está prevista para o dia 20/12.

Olimpíada Brasileira de Saúde e Meio Ambiente da Fiocruz anuncia os vencedores dia 26/11, no Campus Manguinhos, com transmissão on line
Na sua décima segunda edição, a Obsma Fiocruz contou com 2.478 professores e 44.091 alunos participantes. Da Regional Norte, concorrem à premiação nacional trabalhos do Amazonas, Rondônia e Pará

Divulgada 1ª republicação da chamada pública do processo de seleção pública de candidatos para ingresso no Curso de Mestrado Acadêmico do PPGBIO-Interação
Republicação apresenta alterações do Anexo I (Cronograma do processo de seleção) e no Anexo V (Instrução para pagar GRU).

Fiocruz Amazônia discute impacto da crise climática na mobilidade urbana, trânsito e transporte em fórum da UFG
Desafios e inovações no campo da mobilidade urbana e do trânsito foram o foco do evento, aberto com palestra ministrada pelo epidemiologista Jesem Orellana, pesquisador da Fiocruz Amazônia

Centro de estudos da Fiocruz Amazônia apresentará palestra sobre saúde mental e meio ambiente
Palestra discutirá sobre como as mudanças climáticas interferem na saúde mental dos indivíduos.

OPAS, Ministério da Saúde e Fiocruz Amazônia realizam em Manaus, curso internacional sobre biologia, ecologia e vigilância de vetores do vírus Oropouche nas Américas
Até sexta-feira, 22/11, os técnicos devem participar de apresentações com a presença de especialistas, debates; trabalhos de grupo e atividades práticas em campo, e no laboratório de entomologia.
Fiocruz Amazônia, OPAS e Ministério da Saúde realizam oficina sobre taxonomia de Culicoides, transmissores da febre Oropouche, para entomólogos de nove países das Américas e do Caribe
Curso tem como propósito atualizar os participantes nas tecnologias existentes e nas formas de realizar e manter a vigilância do vetor, fortalecendo os sistemas de vigilância entomológica, de alerta prévio e respostas para mitigar a transmissão do Oropouche nos países

Fiocruz Amazônia divulga resultado final da 1ª etapa do processo seletivo para ingresso no curso de mestrado do PPGVIDA
As aulas iniciam no dia 17 de março de 2025.

Divulgado resultado dos pedidos de recursos sobre 1ª etapa do processo seletivo do PPGVIDA
A divulgação do resultado final está prevista para o dia 20/12

Fiocruz Amazônia participa de diálogo estratégico para a bioeconomia durante Expo Amazônia Bio&Tic 2024
O encontro visa oportunizar a interação de startups com os principais stakeholders de setores comerciais estratégicos da Bioeconomia.

Fiocruz Amazônia tem trabalho de pós-graduação premiado na XVII Reunião Nacional de Pesquisas em Malária, em Belém
Pôster da aluna do PPGBIO-INTERAÇÃO ficou em segundo lugar entre os mais de 160 trabalhos expostos

Fiocruz Amazônia divulga inscrições homologadas para o processo seletivo do PPGVIDA
A divulgação do resultado final está prevista para o dia 20/12.

Fiocruz Amazônia realiza mapeamento de áreas de risco para surtos de raiva no Estado do Amazonas
Etudo foi apresentado durante a mesa-redonda “Raiva: uma Questão de Saúde Única”, promovida pela ADAF, no Auditório do Bosque da Ciência, no INPA, reunindo estudantes, pesquisadores e profissionais e autoridades de saúde animal do Estado

Centro de Estudos vai abordar avanço das políticas públicas de saúde por meio do Programa Saúde na Escola nesta sexta-feira, 8/11
A palestra terá como moderadora a pesquisadora da Fiocruz Amazônia, Amândia Braga, do Laboratório de Situação de Saúde e Gestão do Cuidado de Populações Indígenas e outros grupos vulneráveis (SAGESPI) do ILMD/Fiocruz Amazônia

Fiocruz Amazônia recebe representantes da Unidade de Controle Interno da Fiocruz/RJ para orientações e compartilhamento de boas práticas
Finalidade da visita foi discutir temas ligados ao controle interno do ILMD/Fiocruz Amazônia e promover o compartilhamento de boas práticas visando um melhor desempenho de atividades desenvolvidas na unidade.

Fiocruz Amazônia sedia palestra de pesquisadora polonesa sobre impacto da pandemia de Covid-19 na demografia da Europa Central
Aneta Afelt é geógrafa e pesquisadora do Centro Interdisciplinar de Modelagem Matemática e Computacional da Universidade de Varsóvia, trabalhando com geografia da saúde, ciência ambiental,e análises epidemiológicas complexas

Fiocruz Amazônia irá transmitir para público externo disciplina sobre biologia, ecologia e controle de doenças transmitidas por vetores na região Amazônica
Alunos de outros programas de pós-graduação, de diferentes instituições de ensino, podem ter acesso as aulas.

Fiocruz Amazônia e CRIS Fiocruz acompanham ministro da Saúde da Alemanha e apresentam projetos desenvolvidos em favor da saúde das populações ribeirinhas
Agenda especial em Manaus foi cumprida um dia antes da participação de Karl Lauterbach no Encontro dos Ministros de Saúde do G20, no Rio de Janeiro. A missão foi coordenada pela Fiocruz Amazônia e a Coordenação de Cooperação com a Europa do CRIS Fiocruz

Projeto Mosaic inicia etapa de coleta de dados na área da Tríplice Fronteira Brasil/Peru e Colômbia
Projeto tem como finalidade implementar ecossistemas de informação multimodais abertos e replicáveis acerca da saúde das populações nas áreas de fronteira do Brasil com a Guiana Francesa e a Colômbia e Peru, e na fronteira entre Quênia e Tanzânia

Fiocruz Amazônia divulga resultado dos pedidos de isenção da taxa para processo seletivo do Curso de Doutorado Acadêmico do PPGBIO-Interação
As inscrições iniciam no dia 29/10 e se estendem até 27/11.

Fiocruz Amazônia promove V Workshop Estratégico de Pós-graduação
A atividade tem por objetivo, apresentar temas específicos, relacionados ao funcionamento, missão, formas de apoio ao estudante.

Divulgado resultado dos pedidos de isenção da taxa de inscrição para processo seletivo do Curso de Mestrado Acadêmico do PPGBIO-Interação
As inscrições iniciam no dia 29/10 e se estendem até 22/11.

Exposições científicas e circuito ambiental marcam encerramento das atividades da Fiocruz Amazônia na SNCT
Durante a visitação, alunos da rede municipal de ensino tiveram a oportunidade de conhecer estudos e projetos desenvolvidos pela Fiocruz Amazônia em diversas áreas do campo científico.

Fiocruz Amazônia abre inscrições para ingresso no Curso de Doutorado Acadêmico do PPGBIO-Interação
As inscrições iniciam no dia 29/10 e se estendem até 27/11.

Fiocruz Amazônia abre inscrições para ingresso no Curso de Mestrado Acadêmico do PPGBIO-Interação
O período para solicitar isenção de taxa de inscrição, acontece nos dias 21 e 22/10.

SNCT: Fiocruz Amazônia lança série de podcasts destacando pesquisas que impactam a sociedade sobre saúde e meio ambiente
Divididos em seis episódios, os podcasts possuem autoria de conteúdo desenvolvido por estudantes, pesquisadores, jornalistas e outros profissionais que cursaram a Oficina Ouvirciência,

Fiocruz Amazônia recebe visita do novo cônsul-geral do Japão em Manaus
A visita tem por finalidade apresentar ao novo cônsul a Fiocruz Amazônia, vislumbrando parcerias e cooperações futuras.

Doenças de veiculação hídrica são abordadas durante atividade da SNCT 2024 em Tabatinga-AM
Oficina chama a atenção para a importância das medidas de higiene, sobretudo a lavagem das mãos, na prevenção a doenças
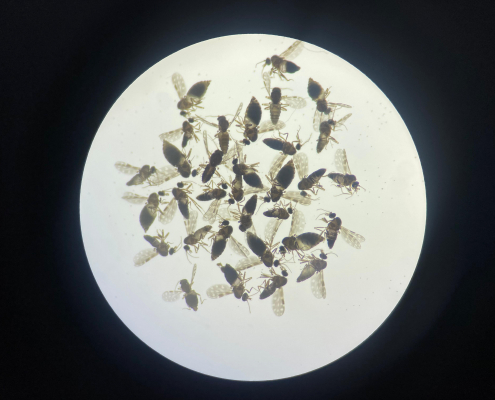
Oficina da Fiocruz Amazônia mostra como é feita a extração do DNA humano para estudantes do Alto Solimões e estimula o interesse pela formação científica
A finalidade é proporcionar um contato mais próximo entre os estudantes da região e o conhecimento científico, produzido nos laboratórios de pesquisa da instituição.

Divulgado resultado da análise dos pedidos de isenção da taxa de inscrição para processo seletivo do PPGVIDA
As inscrições se estendem até o dia 4/11.

Fiocruz Amazônia promove abertura da programação da SNCT 2024 e alinhamento das equipes que atuarão nas atividades
Atividades acontecerão entre os dias 14 e 18/10, nas cidades de Manaus, Presidente Figueiredo e Tabatinga, reunindo equipes dos laboratórios da unidade, sob a coordenação da Vice-Diretoria de Pesquisa e Inovação (VDPI), com o apoio da Fundação de Amparo à Pesquisa do Estado do Amazonas (Fapeam)

Fiocruz Amazônia inicia curso de formação do QualificaSUS para novos agentes comunitários de saúde da Semsa-Manaus
Aulas iniciaram na segunda-feira, 14/10, no âmbito do Programa QualificaSUS, em parceria com a Escola de Saúde Pública (ESAP) e Secretaria Municipal de Saúde (Semsa-Manaus)

Fiocruz Amazônia realiza oficina de autoavaliação dos cursos de pós-graduação stricto sensu
Objetivo é identificar as fortalezas e desafios, além de apresentar sugestões de aprimoramento e fomentar o debate sobre o stricto sensu, com vistas à quadrienal 2021-2024 da CAPES

Colaboradoras da Fiocruz Amazônia participam de palestra sobre prevenção ao câncer de mama
O palestrante esclareceu dúvidas e pontuou aspectos e fatores de risco

Fiocruz Amazônia realiza Centro de Estudos sobre ramo da Estatística denominado Análise de Sobrevivência
Palestra será transmitida via plataforma Zoom e terá como moderador o epidemiologista e pesquisador da Fiocruz Amazônia, Jesem Orellana, chefe do Laboratório de Modelagem em Geoprocessamento e Epidemiologia, do ILMD/Fiocruz Amazônia

Fiocruz Amazônia realiza atividades na capital e interior durante a Semana Nacional de Ciência e Tecnologia (SNCT)
A 21ª Semana Nacional de Ciência e Tecnologia (SNCT), promovida pelo Ministério da Ciência Tecnologia e Inovação (MCTI) busca difundir e popularizar a ciência ampliando o alcance das atividades de institutos de pesquisa no País

Etapa Regional Norte seleciona trabalhos de escolas do AM, PA e RO para a 12ª Olimpíada Brasileira de Saúde e Meio Ambiente
Vencedores das etapas regionais concorrem à premiação nacional, em novembro próximo, quando um professor e um aluno representantes de cada trabalho premiado participarão da cerimônia de premiação no Rio de Janeiro

Fiocruz Amazônia prestigia lançamento de edital da Fapeam para transferência de tecnologias voltadas ao enfrentamento de eventos climáticos extremos
Iniciativa visa credenciar instituições públicas, privadas e sem fins lucrativos interessadas em atuar na transferência de tecnologias a partir de aporte financeiro de até R$ 50 mil

Livro de poesia sobre a Pandemia de Covid-19 é lançado na Fiocruz Amazônia
Com 150 páginas, editado pelo Grupo Scortecci, o livro é um relato poético feito num momento de incertezas vivido pela população em decorrência da falta de oxigênio nos hospitais da cidade

Novo canal para profissionais que atendem pacientes com malária é disponibilizado pela Saúde
Serviço é resultado da colaboração entre Ministério da Saúde e especialistas do Instituto Leônidas e Maria Deane (ILMD/Fiocruz Amazônia), da Fundação de Medicina Tropical Doutor Heitor Vieira Dourado (FMT-HVD) e da Fundação de Vigilância em Saúde do Amazonas - Drª Rosemary Costa Pinto (FVS-RCP)

Acolhida aos novos alunos de Iniciação Científica conta com palestra e treinamentos na Fiocruz Amazônia
Programa de Iniciação Científica da Fiocruz Amazônia visa a formação de recursos humanos para a pesquisa em saúde e o desenvolvimento científico de jovens estudantes de graduação de Instituições de Ensino Superior (IES) públicas e privadas reconhecidas pelo Ministério da Educação

Fiocruz Amazônia promove ações de popularização científica sobre saúde entre estudantes da rede municipal de ensino
Durante a ação, os alunos tiveram de representar, através de desenhos, e outras atividades lúdicas, quais conceitos de saúde eles compreendem dentro suas respectivas realidades.

Fiocruz Amazônia realiza Centro de Estudos sobre “Hesitáncia vacinal entre mães venezuelanas em Manaus-AM”
Palestra terá como foco estudo de base etnográfica, parte de uma pesquisa comparativa desenvolvida em cidades de seis estados brasileiros e que explorou aspectos da hesitância vacinal entre mulheres venezuelanas em Manaus, Amazonas, no contexto do COVID-19

Fiocruz Amazônia sedia reunião do Ciamp-Rua Nacional para escuta das demandas da população em situação de rua e assinatura de termo de compromisso entre município e Ministério dos Direitos Humanos
O Ciamp-Rua Nacional vem realizando reuniões descentralizadas nas cinco regiões do País com a finalidade de avançar no debate sobre a política nacional para população de rua. A reunião de Manaus é a décima segunda ordinária e a quarta descentralizada, realizada este ano

Em parceria com a Fiocruz Amazônia, UEA realiza simpósio científico de integração em saúde coletiva na Amazônia
As inscrições podem ser feitas até 30/9.

Fiocruz Amazônia participa do 6º Congresso da Sociedade Brasileira de Proteômica, em São Paulo
Programação envolveu realização de cursos de treinamento e simpósios com temas variados relacionados à Proteômica e Metabolômica. Este ano, a Fiocruz Amazônia participou do evento com a maior comitiva, desde a primeira edição, formada por dez pessoas, entre discentes e pesquisadores

Fiocruz Amazônia ministra curso no RN sobre bioecologia do Culicoides paraensis, o Maruim, vetor da febre Oropouche
O curso teve uma carga horária de 36 horas e foi destinado a estudantes do Laboratório de Pesquisa em Entomologia Médica da Universidade Federal do Rio Grande do Norte (UFRN) e profissionais entomólogos da Secretaria de Saúde do Estado /p>

Fiocruz Amazônia sediará lançamento do livro PanPoéticaDemia, de José Seráfico, no dia 30/09
A coletânea de poesias e poemas traz o prefácio assinado pelo médico infectologista Marcus Vinícius Guimarães de Lacerda, pesquisador especialista da Fiocruz Amazônia, que trabalhou intensamente em pesquisas voltadas ao enfrentamento da Covid-19

Pesquisador da Fiocruz Amazônia sugere medidas de efeito rápido para reduzir danos causados pela fumaça que encobre Manaus
Orellana recomenda distribuição, pelos órgãos de saúde estadual e municipal, de máscaras N95 ou PFF2 para grupos prioritários, incluindo trabalhadores ambulantes, entregadores de aplicativo, trabalhadores da limpeza pública, guardas de trânsito e do transporte coletivo

Fiocruz Amazônia recebe visita de técnicos do Almoxarifado da Cogead-RJ
Objetivo foi conhecer a estrutura do setor de almoxarifado da unidade da Fiocruz, no Amazonas, e promover uma avaliação para futuros ajustes necessários ao melhor funcionamento dos serviços de armazenagem, controle dos produtos e materiais no local

Fiocruz Amazônia promove oficina de criação de podcasts para divulgação de pesquisas
O resultado será apresentado na Semana Nacional de Ciência e Tecnologia de 2024.

Incubadora de soluções em saúde da Fiocruz Amazônia promove jornada de inovação tecnológica
A ação faz parte das atividades de disseminação da inovação, promovida pela FIOBiz.

Fiocruz Amazônia faz a entrega dos alimentos arrecadados em campanha solidária no aniversário de 30 anos da unidade
Donativos foram entregues à Casa dos Filhos, entidade filantrópica que atende a crianças em situação de risco e vulnerabilidade social e que funciona no contraturno escolar, oferecendo atividades educativas e recreativas, atendimento psicossocial e alimentação saudável a 60 crianças na Zona Norte de Manaus

Encerramento do V Encontro de Pós-Graduação premia trabalhos científicos submetidos e enaltece importância dos discentes para a instituição
Êxito do evento foi resultado do trabalho em parceria desenvolvido pela comissão organizadora, formada por pesquisadores e pós-graduandos do ILMD/Fiocruz Amazônia

Fiocruz Amazônia realiza acolhida aos alunos da edição 2024-2025 do Programa de Iniciação Científica
Participantes terão oportunidade de assistir palestra da médica veterinária e pesquisadora da Fiocruz Amazônia Alessandra Nava sobre “O papel do pesquisador no antropoceno”

Fiocruz Amazônia destaca o papel da formação do VigiFronteiras na promoção de soluções para agravos na região
Abertura aconteceu no Auditório da Escola de Enfermagem da Universidade Federal do Amazonas (UFAM) e as demais atividades da programação seguem ocorrendo na sede do ILMD/Fiocruz Amazônia, até sexta-feira, 13/09

Centro de Estudos da Fiocruz Amazônia irá abordar “Biobancos e Biorrepositórios”
Esta edição do Centro de Estudos é organizada pelo Laboratório Instituto de Pesquisa Clínica Carlos Borborema (LAB-IPCCB) da Fiocruz Amazônia.

Fiocruz Amazônia realiza abertura oficial do V Encontro de Pós-Graduação da Instituição
O evento promove a integração entre docentes e discentes, incluindo alunos de Iniciação Científica.
Fiocruz Amazônia apresenta resultados de pesquisa participativa no III Seminário Acesso à Saúde e Vulnerabilidades de Migrantes internacionais no Contexto da Disseminação da Covid-19
Objetivo do evento foi discutir os principais achados da pesquisa interdisciplinar, que contou com a participação de pesquisadores de seis estados (Amazonas, Minas Gerais, São Paulo, Mato Grosso, Paraná e Santa Catarina), oito instituições de pesquisa, além de consultores internacionais, migrantes, gestores e profissionais de saúde

Fiocruz Amazônia tem Regulamento da Pesquisa e Inovação aprovado pelo Conselho Deliberativo da instituição
Aprovação ocorreu durante reunião ordinária realizada no último dia 27/08/2024. Documento passa a reger as atividades de pesquisa desenvolvidas na instituição

Fiocruz Amazônia e Queen Mary University desenvolvem projeto sobre segurança alimentar em comunidades ribeirinha e de favela no Amazonas e Rio de Janeiro
Objetivo é construção futura de um projeto robusto que buscará compreender os fatores que impactam a segurança alimentar nesses territórios e prevenir problemas que impactam diretamente a saúde destas populações

Fiocruz Amazônia realiza Centro de Estudos sobre o tema “Hemoparasitos de Herpetofauna: revelando componentes ocultos da biodiversidade”
Palestrante tem experiência nas áreas Zoologia e Parasitologia, atuando principalmente nos temas: herpetologia; protozoologia; diversidade; sistemática e taxonomia; e relações ecológicas e evolutivas entre parasitos e seus hospedeiro

Fiocruz Amazônia inaugura Espaço Saúde e Bem-Estar para comunidade
Espaço é destinado a trabalhadores e discentes do ILMD/Fiocruz Amazônia efuncionará com regras para otimização dos serviços oferecidos, de segunda a sexta-feira, das 8h às 17h.

Fiocruz Amazônia e Universidade Nacional da Colômbia dão prosseguimento às tratativas para acordo de cooperação em pesquisa, ensino e mobilidade de estudantes e pesquisadores
Finalidade é desenvolver esforços conjuntos que possibilitem avançar em ações nas áreas de pesquisa, formação e intercâmbio de conhecimentos. Plano de trabalho deverá ser assinado em outubro, na sede da UNAL

Matrícula institucional para Curso de Doutorado em Saúde Pública na Amazônia ocorre até hoje, 27/8
Matrículas institucionais serão feita até hoje.

Fiocruz Amazônia prestigia solenidades de troca de comando na Chefia do Estado Maior do Comando Militar da Amazônia e 2º Grupamento de Engenharia
Atos ocorreram na Chefia do Estado Maior do Comando Militar da Amazônia e do 2º Grupamento de Engenharia (Grupamento Rodrigo Octávio), respectivamente na noite da última quinta-feira, 22/08, e na manhã desta sexta-feira, 23/08

Fiocruz Amazônia inicia processo de inscrições às oficinas OuvirCiência e DigiCiência
Atividades são prévias da programação da Semana Nacional de Ciência e Tecnologia 2024, oferecidas por meio dos projetos “CiênciaPop: Fiocruz Amazônia na SNCT 2024” e, “CiênciaPop ILMD/Fiocruz Amazônia: popularizando a ciência em saúde por meio de ferramentas digitais”, com apoio da Fundação Oswaldo Cruz (Fiocruz) - Edital de Apoio às Unidades Técnico-Científicas e aos Escritórios Regionais da Fundação, e da Fundação de Amparo à Pesquisa no Amazonas (Fapeam)

Divulgado resultado final do processo seletivo para ingresso no Curso de Doutorado em Saúde Pública na Amazônia
Confira a lista de aprovados(as) no processo seletivo.

Fiocruz Amazônia encerra comemorações pelos 30 anos em clima de Folguedos no Teatro Amazonas
Espetáculo do Balé Folclórico do Amazonas encerrou temporada de dez anos nesta terça-feira, 20/08, no Teatro Amazonas, prestando uma homenagem à Fiocruz Amazônia

Fiocruz Amazônia recebe homenagem durante Cessão de Tempo na Assembleia Legislativa do Amazonas
Homenagem foi propositura da deputada estadual Mayara Pinheiro, presidente da Comissão de Saúde e Previdência da ALEAM, pelos relevantes serviços prestados pela Fiocruz Amazônia nas diversas áreas de atuação

Fiocruz Amazônia prorroga até 26/08 as inscrições para o V Encontro de Pós-Graduação
Finalidade é ampliar alcance do evento, aberto a alunos de programas de pós-graduação de instituições interessadas em aprofundar as discussões acerca do papel dos pós-graduandos frente aos desafios globais

Fiocruz Amazônia homenageia ex-diretores da instituição e anuncia criação da Medalha Leônidas e Maria Deane
Na ocasião, foi anunciada a criação da Medalha Leônidas e Maria Deane, comenda que será instituída por meio de portaria, passando a vigorar a partir de 2025, com a finalidade de reconhecer e homenagear pessoas que contribuíram com a instituição

Presidente da Fiocruz anuncia para primeiro semestre de 2025 o início da licitação para construção da nova sede da Fiocruz Amazônia
Anúncio foi feito durante a cerimônia em comemoração aos 30 anos de existência do Instituto Leônidas e Maria Deane (ILMD/Fiocruz Amazônia), comemorados nesta segunda-feira, 19/08, com uma homenagem aos parlamentares do Amazonas que apoiam a instituição

Delegação da Fiocruz Amazônia embarca para 1° Jornada Nacional de Iniciação Científica da Rede Provoc
Comitiva é composta por três pesquisadoras da Instituição e 16 estudantes de ensino médio, da Rede Estadual de Ensino, bolsistas do programa.

Fiocruz Amazônia abre as portas para mais uma festa da vacinação e da saúde em Manaus
Fiocruz Pra Você marcou também o início da programação de aniversário de 30 anos da Fiocruz Amazônia, com a entrega dos murais grafitados pelo artista paraense Rogério Soares

Fiocruz Amazônia realizará V Encontro de Pós-Graduação, de 9 a 12/09, para debater papel do pós-graduando frente aos desafios globais
Evento se propõe a discutir e divulgar avanços nas pesquisas científicas realizadas pelos pós-graduandos dos programas de pós-graduação do ILMD/Fiocruz Amazônia, promovendo maior integração entre docentes e discentes

Fiocruz Amazônia realiza Centro de Estudos sobre o tema “A bioquímica das proteínas pode nos ajudar a compreender o vírus Oropouche?”
Pesquisador busca entender como os vírus alteram a composição e a arquitetura das membranas intracelulares e como eles escapam do reconhecimento imunológico pelo hospedeiro

Fiocruz Amazônia recomenda uso de máscaras nesse período crítico de exposição à fumaça em Manaus
Pesquisador aleta que este ano poderemos ter um período mais longo de exposição à fumaça tóxica, já que o pico da poluição ocorre geralmente em outubro

Fiocruz Amazônia de portas abertas para comemorar os 30 anos com vacinação e testagem para gestantes no Fiocruz Pra Você
Evento acontece anualmente nas unidades da Fiocruz no Brasil. Este ano, será no dia 17/08, das 8h às 16h, oferecendo serviços, como vacinação, aferição de pressão, exames de glicemia, além de atividades recreativas e de interação científica

Divulgada 5ª Republicação do processo seletivo para ingresso no curso de doutorado Acadêmico Em Saúde Pública na Amazônia
Confira retificação da data de divulgação do resultado dos recursos do resultado final do processo seletivo.

Centro de Estudos da Fiocruz Amazônia irá abordar vigilância em saúde de populações expostas ao mercúrio no Baixo Tapajós
Palestra vai enfocar as consequências para a saúde e a importância da vigilância em saúde das populações expostas ao mercúrio

Projeto Comunitário de Saúde Santa Maria elege práticas esportivas como estratégia indutora da melhoria da qualidade de vida na comunidade
Resultados práticos obtidos pelo projeto, ao longo dos dois anos de implementação na localidade, situada na zona rural de Manaus, na margem esquerda do Rio Negro, já são perceptíveis

Bosquinho e Oswaldinho comemoram os 70 anos de instalação do INPA em Manaus
Fiocruz Amazônia prestigiou a comemoração levando para o Bosque da Ciência, o Oswaldinho, mascote da Olimpíada Brasileira de Saúde e Meio Ambiente (Obsma), e o jogo interativo do Tapetão dos ODS

Fiocruz Amazônia prestigia formatura em homenagem aos 54 anos do 2º Grupamento de Engenharia do Exército Brasileiro
Evento foi marcado pela reinauguração do Memorial Rodrigo Octávio, espaço dedicado à exposição de acervo contando a história do Grupamento e seu patrono, General Rodrigo Octávio

Fiocruz realiza cerimônia de assinatura do Termo de Doação do Imóvel, sede do ILMD
A ação é um marco histórico para a Unidade, que oficializa a doação do imóvel de forma definitiva

Fiocruz Amazônia realiza encontro para discutir direitos à saúde para mulheres migrantes
Objetivo do evento é promover a troca de experiências entre profissionais do SUS, nas diferentes esferas, e mulheres migrantes, no contexto amazônico.

Fiocruz Amazônia assina protocolo de intenções com Governo do Estado para cooperação em atividades de ciência, tecnologia e inovação visando o enfrentamento às mudanças climáticas
Além da Fiocruz Amazônia, documento tem também como signatários o Instituto Nacional de Pesquisas da Amazônia (INPA), Empresa Brasileira de Pesquisa Agropecuária (Embrapa), Universidade Federal do Amazonas (UFAM) e Instituto Federal do Amazonas (IFAM)

Programa de Mobilidade Acadêmica da Fiocruz seleciona alunos do PPGBIO-Interação, do ILMD/Fiocruz Amazônia
A chamada disponibilizou apoio financeiro para até 10 discentes

Divulgado cronograma de entrevistas do processo seletivo para curso de doutorado acadêmico em Saúde Pública na Amazônia
O Curso será ministrado em regime integral, com duração mínima de 24 meses, e máxima de 48 meses, incluindo a realização da defesa de tese.

PPGBIO-Interação lança edital para participação em eventos científicos
Esta chamada disponibiliza o apoio financeiro para até 8 (oito) discentes regularmente matriculados a nível de mestrado ou doutorado no PPGBIO-Interação.

Fiocruz Amazônia leva alunos do Ensino Médio para 1ª Jornada Nacional do Provoc no Rio de Janeiro
Evento reunirá alunos de todas as unidades e escritórios regionais da Fiocruz, no País, onde o programa tenha sido implementado e esteja em pleno funcionamento

PPGBIO-Interação lança chamada interna para Mobilidade Acadêmica
A divulgação do resultado final, ocorre no dia 15/8 de 2024.

Fiocruz Amazônia apresenta áreas de atuação em pesquisa aos embaixadores da Associação das Nações do Sudeste Asiático
Finalidade da visita foi conhecer a instituição com vistas à prospecção de futura cooperação com a Fiocruz, mais especificamente no tema de doenças tropicais, além de intercâmbios de pesquisadores

Centro de Estudos abordará metodologia, formulários e resultados da coleta para os Povos e Comunidades Tradicionais
O pesquisador, abordará ainda os desafios enfrentados e a mudança no panorama das populações indígenas desde o último Censo de 2010.

Fiocruz Amazônia avança na discussão acerca do Regulamento da Pesquisa na instituição
O regulamento estabelece, entre outras pautas, as diretrizes de funcionamento dos laboratórios e do Núcleo de Inovação Tecnológica (NIT)

Fiocruz Amazônia comemora 30 anos com três dias de eventos em espaços simbólicos para a região no próximo mês de agosto
Eventos científicos, culturais, de popularização da ciência, difusão do conhecimento e homenagens marcarão as festividades, começando, no dia 17/08, sábado

Prorrogadas as inscrições para seleção de alunos externos do PPGVIDA, PPGBIO-INTERAÇÃO e DASPAM
As inscrições podem ser feitas até o dia 14/7

Divulgado resultado da Prova de Saúde Coletiva do programa DASPAM
Para esta Chamada Pública estão sendo oferecidas até 15 vagas, para ingresso a partir de setembro de 2024.

Doutorado Acadêmico em Saúde Pública na Amazônia abre inscrições para candidatos externos
As inscrições ocorrerão no período de 09 a 12 de julho de 2024

Fiocruz Amazônia inscreve para seleção de vagas de aluno especial do PPGBIO-INTERAÇÃO
As inscrições ocorrerão no período de 09 a 12 de julho de 2024

Fiocruz Amazônia abre inscrições para Chamada de Aluno Especial do PPGVIDA
As inscrições ocorrerão no período de 09 a 12 de julho de 2024

Laboratório de Modelagem em Estatística, Geoprocessamento e Epidemiologia do ILMD/ Fiocruz Amazônia promove Seminário Interno de Integração
Ao todo, 24 pessoas participaram da programação e todos apresentaram seus projetos ou iniciativas que os vincula ao LEGEPI

Estações Disseminadoras de Larvicidas da Fiocruz Amazônia se tornam política pública do Ministério da Saúde para o controle do Aedes em todo o País
A medida visa expandir a tecnologia das EDLs, com o acompanhamento do Ministério da Saúde e apoio técnico da Fiocruz

Fiocruz Amazônia estará presente à 76ª Reunião da SBPC, em Belém (PA)
Instituição levará jogos e atividades sobre coleções biológicas do bioma amazônico, Olimpíada Brasileira de Saúde e Meio Ambiente e projeto do Ciência Pop, além de ter doutoranda premiada pelo CNPq durante o evento

Projeto de formação de trabalhadores da Saúde no cuidado das populações do Campo, Floresta e Águas reúne em Manaus equipe de facilitadores e articuladores que atuarão nos territórios
Participaram, no total, 69 pessoas, sendo 31 facilitadores, oito articuladores, seis coordenadores e quatro conteudistas, dos Estados do Pará, Amapá, Maranhão, Acre e Amazonas, além de convidados de secretárias estaduais e municipais, Cosems-PA, Cosems-AC, Cosems-AM e Ministério da Saúde

Seminário discute Amazônia no contexto dos eventos climáticos extremos
O evento reuniu especialistas de diversas instituições para discutir os desafios socioambientais e de saúde na Amazônia.

PROFSAUDE divulga resultado da terceira etapa – Prova Oral do processo de seleção para o Mestrado
Resultados estão disponíveis no site da Fiocruz Amazônia. Provas foram aplicadas na Sala 101, ILMD/Fiocruz Amazônia,, conforme disposição de horários estabelecida pela Comissão de Seleção

Fiocruz Amazônia passa a integrar Conselho Estadual de Recursos Hídricos do Amazonas
Representando a Fiocruz Amazônia no colegiado, a bióloga Luciete Almeida, chefe do Núcleo de Bacteriologia do Laboratório Diversidade Microbiana da Amazônia com Importância para a Saúde (DMAIS)

Prorrogadas as inscrições ao processo de seleção de candidatos ao Doutorado em Saúde Pública na Amazônia
Inscrições se encerrariam nesta quinta-feira, 20/06, e foram prorrogadas até as 16h da próxima segunda-feira, 24/06. Os interessados devem acessar o edital da Chamada Pública 05/2024 no site da Fiocruz Amazônia

Fiocruz Amazônia realiza Centro de Estudos sobre o tema “Insegurança alimentar entre povos e comunidades tradicionais” nesta sexta-feira, 21/06
Palestra abordará aspectos de uma análise crítico-reflexiva sobre a aplicabilidade da Escala Brasileira de Segurança Alimentar no contexto das particularidades de povos e comunidades tradicionais

Seminário de Avaliação e Acompanhamento do PROEP-LABS é realizado pela Fiocruz Amazônia
Finalidade foi apresentar os resultados parciais e prestação de contas dos projetos que contam com financiamento do programa, que visa a promoção da excelência na pesquisa, inovação e o desenvolvimento tecnológico em saúde nos Laboratórios de Pesquisa do instituto

Fiocruz Amazônia recebe equipe do Cogig para a primeira manutenção preventiva e corretiva de 2024
Nesta visita, foram atendidos 378 equipamentos, entre manutenção preventiva, inspeções, manutenção corretiva e qualificação de cabines, entre outras atividades
Fiocruz Amazônia é destaque na Conferência de Migração da Associação Brasileira de Antropologia
Conferências foram possíveis graças à chamada pública aberta pelo Comitê Nacional para os Refugiados (Conare) visando a realização de conferências preparatórias à 2ª Conferência Nacional de Migrações, Refúgio e Apátrida (Comigrar)

Fiocruz Amazônia prestigia sessão especial em homenagem aos 20 anos da Fundação de Vigilância em Saúde do Amazonas Dra Rosemary Costa Pinto
Parceria mantida entre a Fiocruz Amazônia e a FVS-RCP é destacada, com cooperação científica que garante a execução conjunta de projetos na área de doenças infecciosas no Amazonas

Especialista alerta para técnicas de neuromarketing que manipulam comportamento de consumo de alimentos ultraprocessados
Nutricionista e doutora em Ciências Biológicas, Isabel de Paula Antunes David, abordou tema durante palestra do Centro de Estudos, promovido pelo Laboratório de Modelagem em Estatística, Geoprocessamento e Epidemiologia (Legepi) no último dia 7/06

Fiocruz Amazônia participa de reunião final do Ministério da Saúde para detalhamento de um programa de saúde para a Amazônia Legal
Grupo conta com representantes de todas as Secretarias do Ministério da Saúde, do Instituto Evandro Chagas, da Fundação Oswaldo Cruz (Fiocruz) e da Agência Nacional de Vigilância Sanitária (Anvisa)

Fiocruz Amazônia premia destaques da 21ª Raic e expõe trabalhos da II Jornada do Programa de Vocação Científica
Evento reforça a importância da iniciação científica na construção do conhecimento e incentiva os jovens pesquisadores a prosseguirem nas carreiras acadêmicas.

Fiocruz Amazônia e Ibama-AM firmam acordo de cooperação técnica pioneiro para realização de pesquisas em One Health
ACT tem por objeto estabelecer a cooperação entre o Centro de Triagem de Animais Silvestres do Ibama (Cetas-AM) e a Fiocruz Amazônia, por meio de apoio técnico, científico e operacional

Centro de Estudos aborda estratégias de proteção contra a publicidade de alimentos ultraprocessados
Palestrante irá abordar as técnicas de neuromarketing, aplicadas pela indústria, com base na neurociência, como forma de persuasão implícita e promoção dos seus produtos

Fiocruz Amazônia realiza exposição dos Trabalhos da II Jornada do Programa de Vocação Científica
28 trabalhos de estudantes da rede pública de ensino de Manaus, sendo 21 da etapa iniciação e 7 da etapa avançado, serão expostos para a comunidade acadêmica e científica

PPGBIO-Interação apoia realização de Simpósio Internacional de Imunologia e Hematologia do Amazonas
Para a coordenação do PPGBIO-Interação, evento agrega na difusão do conhecimento de temas de relevância em Imunologia, Hematologia, doenças infecciosas e a interação Patógeno-Hospedeiro

Fiocruz Amazônia apresenta estudos sobre rosetas em Plasmodium Vivax durante Simpósio Internacional de Imunologia e Hematologia
O evento reúne pesquisadores, professores, profissionais e acadêmicos a nível de graduação, mestrado e doutorado, com programação científica e social, sendo realizados minicursos, palestras e workshops com representantes nacionais e internacionais da área de imunologia e hematologia.

21ª RAIC da Fiocruz Amazônia inicia com palestra sobre combate à desinformação na saúde pública
Até o último dia de evento, 42 trabalhos de graduandos de diferentes Instituições de Ensino de Manaus, serão apresentados.

Fiocruz Amazônia lançará série de podcasts sobre os 10 anos do LAHPSA no próximo dia 20/06
Ao todo, serão12 episódios, divididos por temas e áreas de atuação do laboratório, narrando os avanço e conquista nos primeiros 10 anos de atividades do LAHPSA

Projeto Moetá volta à Colônia Antônio Aleixo para desenvolver ações interdisciplinares em saúde e meio ambiente, na primeira devolutiva em parcerias com instituições
Durante a primeira visita, intenção foi estabelecer contato com dirigentes e profissionais das instituições para dar início um diálogo com vistas à implementação do Projeto

PROFSAUDE divulga resultado definitivo da segunda etapa e prova oral dos candidatos classificados
Prova será no dia 12/06, na Sala 101, primeiro andar do Instituto Leônidas & Maria Deane (ILMD/Fiocruz Amazônia), das 9h às 15h30

21ª RAIC da Fiocruz Amazônia destacará “Infodemia” e maneiras de combatê-la na era da informação
A Raic é um evento que acontece anualmente em todas as unidades da Fiocruz. Durante a reunião, os bolsistas do PIC-ILMD/Fiocruz Amazônia apresentam os resultados dos projetos desenvolvidos no período de vigência do Programa

Fiocruz Amazônia alcança marca de 50 defesas de dissertação realizadas no Mestrado do PPGBIO-Interação
Coordenação do Programa destaca que marca demonstra o crescimento e amadurecimento do PPGBIO Interação e da sua missão formativa de recursos humanos

Fiocruz Amazônia lança selo de aniversário de 30 anos representando a expansão e abertura de espaços para conquistas e parcerias
Lançamento marca início de programação especial alusiva à data, com a presença do selo comemorativo em todas as realizações da unidade até o final do ano, e três dias de eventos festivos no mês de agosto

Fiocruz Amazônia alerta para a problemática do consumo de alimentos ultraprocessados por indígenas em tempos de crise climática durante Congresso Brasileiro de Nutrição
O epidemiologista Jesem Orellana palestrou durante o XXVIII Conbran e chamou atenção para as especificidades regionais, citando o crescente consumo de alimentos ultraprocessados entre crianças Yanomami.

Fiocruz Amazônia lança selo oficial do aniversário de 30 Anos e institui comitê para definição de homenagens durante comemorações em agosto
Lançamento inicia programação de atividades e comemorações do jubileu de pérola da unidade da Fiocruz na Amazônia e de sua importância no desenvolvimento de pesquisas e novas tecnologias, bem como na formação de pessoas na região

Divulgado resultado da análise dos pedidos de isenção da taxa de inscrição para o Processo Seletivo do DASPAM
O Curso será ministrado em regime integral, com duração mínima de 24 meses, e máxima de 48 meses, incluindo a realização da defesa de tese.

Fiocruz Amazônia e USP realizam seminário sobre Cosmopolíticas do Cuidado no fim-do-mundo
Objetivo é fortalecer as discussões do projeto no âmbito da saúde coletiva na Amazônia e construir caminhos, adequações, conexões e composições possíveis com o PPGVIDA

Pesquisadores da Fiocruz Amazônia participam de elaboração de plano para enfrentamento da dengue 2024/2025
Encontro contou com a participação de especialistas em arboviroses, incluindo gestores, pesquisadores e técnicos estaduais e municipais, bem como representantes do Ministério da Saúde, Fiocruz e da Opas

Fiocruz Amazônia apresenta estudos sobre teste rápido para diagnóstico da gripe aviária (H5N1) no Seminário Marco Zero da Chamada Pública CNPq/MCTI
Além de permitir a discussão de aspectos relacionados à execução dos projetos, evento foi também uma oportunidade de formação de parcerias

Abertura da 32ª RAIC é transmitida para bolsistas de Iniciação Científica da Fiocruz Amazônia
A Raic é um evento anual e obrigatório do CNPq, além de ser organizado com a finalidade de acompanhar o progresso dos bolsistas e avaliar o seu rendimento.

Centro de Estudos irá abordar anticorpos antiamarílicos e desfecho da gestação em gestantes que apresentaram infecção por Zika
Palestrante apresentará estudos que abordam a aferição de anticorpos antiamarílicos, por teste de neutralização por redução de placa (PRNT).

Fiocruz Amazônia e presidência da Comissão de Saúde da ALEAM reúnem-se para tratativas estratégicas institucionais
Projetos de pesquisa desenvolvidos pelo Instituto nas áreas de Ciência, Tecnologia, Inovação, Ensino, além da melhoria de infraestrutura, estiveram na pauta da reunião.

Divulgada 1ª Republicação da Chamada Pública do curso de Doutorado em Saúde Pública na Amazônia – DASPAM
A 1ª Republicação considera a oferta de mais uma vaga para o processo seletivo.

Fiocruz Amazônia, Ufam e UEA abrem inscrições para curso de Doutorado Acadêmico Em Saúde Pública na Amazônia
Interessados em solicitar isenção do pagamento da taxa de inscrição, tem até o dia 16/5.

Fiocruz apoia famílias do Rio Grande do Sul
No primeiro momento, rede de solidariedade oferecerá ajuda humanitária, com entrega de água, kits de higiene e outros insumos necessários. As doações serão direcionadas para organizações sociais atuantes e parceiras da Fiocruz no Estado

APG Fiocruz Amazônia inscreve chapas para eleição da diretoria até o dia 10/05/2024 para mandato 2024/2025
De acordo com o Regimento Eleitoral da APG, as chapas deverão ser inscritas em sua totalidade, ou seja, com todos os seis membros

Fiocruz e OPAS capacitam laboratórios de países da América do Sul no diagnóstico molecular e vigilância genômica do vírus Oropouche
Os países sul-americanos, dentre os participantes do workshop, que ainda não confirmaram a circulação do vírus Oropouche certamente passarão a fazê-lo a partir da capacitação em vigilância genômica

Fiocruz Amazônia sedia oficina em Manaus para definição de estratégias de atuação na região do Delta do Tapajós (PA)
Evento teve dois dias de duração e reuniu pesquisadores e coordenadores de áreas estratégicas da VPAPPS, Fiocruz Amazônia e Fiocruz Rondônia

Fiocruz Amazônia realiza Centro de Estudos sobre Biologia dos Arbovírus e Vetores do Vírus Oropouche nesta sexta-feira, 3/05
Surtos de febre Oropouche, no Brasil, especialmente na Região Norte, aumentaram consideravelmente a necessidade de definição de áreas de riscos e o conhecimento sobre os vetores da doença

Pesquisadores do ILMD são reconhecidos com Medalha Zé do SUS pelas contribuições para a melhoria dos SUS no Amazonas
Homenagem integrou o encerramento da 5ª Mostra Aqui tem SUS e a 2ª Oficina Imuniza SUS, com a presença de gestores municipais de saúde, pesquisadores, servidores e agentes da área de saúde do Amazonas

INPA recebe a OBSMA no Projeto Trilhas do Conhecimento no Bosque da Ciência
Objetivo é promover a divulgação científica de forma didática, criativa e divertida, por meio das exposições sobre a biodiversidade. A OBSMA, por sua vez, vai dialogar com os estudantes acerca das questões da sociodiversidade

Pesquisadores da Fiocruz Amazônia abordam avanços e perspectivas no enfrentamento à dengue, em colóquio do Ministério da Saúde
O evento foi realizado de forma híbrida, e contou com participação de também de especialistas e pesquisadores de fora do Brasil.

Pesquisador da Fiocruz Amazônia ministra Aula Inaugural do Programa de Pós-Graduação em Saúde Coletiva na Universidade Federal do Acre
Aula Magna abordou o tema “Feminicídio no Brasil: a construção de um projeto multicêntrico”, e contou com palestra sobre “Desafios das arboviroses na Amazônia: o papel da Saúde Coletiva”, finalizando com roda de conversa, abordando a “Produção do conhecimento na Amazônia: lacunas e oportunidades na Pós-Graduação em Saúde Coletiva”

Projeto Amazônia Solidária lança e-book com relatos sobre desafios da comunicação em saúde em territórios ribeirinhos, quilombolas e de migrantes na Amazônia
Obra reúne narrativas pessoais de apoiadores locais, coordenadores dos eixos, facilitadores e bolsistas do Laboratório de História, Políticas Públicas e Saúde na Amazônia (LAHPSA) sobre as experiências vividas nas atividades de campo do projeto

Saúde do trabalhador, calendário de reuniões e novo regulamento da biblioteca são destaques na reunião do CD Fiocruz Amazônia
Diretora da Fiocruz Amazônia abriu encontro fazendo um balanço das atividades realizadas pela diretoria da instituição, no decorrer deste semestre.

Centro de Estudos abordará o tema “Amazônia, Bioeconomia e Biotecnologia: atuação do laboratório de Micologia do INPA”
Palestra será ministrada pelo pesquisador do Instituto Nacional de Pesquisas da Amazônia João Vicente Braga de Souza

Fiocruz Amazônia abre vagas de estágio para cursos das áreas de TI, Biológicas e Saúde
Podem se inscrever alunos que estiverem cursando a partir do 3° período. Os interessados podem se candidatar até as 12h (horário Brasília) do dia 30/4

PROFSAÚDE divulga lista final de inscrições homologadas e local de prova
O curso visa formar profissionais aptos a atuarem como preceptores para graduação e residência médica em Saúde da Família, com o intuito de contribuir para a melhoria do atendimento dos usuários do Sistema Único de Saúde (SUS)

Fiocruz Amazônia participa de workshop sobre Política de Dados Abertos e Processos de Intercâmbio de Dados entre Países da Tríplice Fronteira
Projeto é fruto de acordo de cooperação entre o Centro Internacional de Formação e Educação para Saúde da Universidade de Washington (UWI-TECH), Fiocruz Amazônia, Centro de Integração de Dados e Conhecimentos para a Saúde (Cidacs-Fiocruz) e Universidade Peruana Cayetano Heredia, com financiamento do Centro de Controle e Prevenção de Doenças dos Estados Unidos (CDC-EUA)

Divulgada análise dos pedidos de recurso e resultado final do processo seletivo para concessão de bolsa de Pós-Doutorado Estratégico do PPGBIO-Interação
Será selecionado para receber a cota de bolsa o candidato CLASSIFICADOS em 1º lugar.

Bolsistas do projeto Moetá participam de capacitação em hanseníase e análise de dados
Atividade faz parte da formação de Comunicadores Populares Especializados em Saúde

Fiocruz Amazônia e Ipem-AM retomam cooperação técnica para uso de Unidade Básica Fluvial para pesquisas nas áreas ribeirinhas
Um novo Termo de Cooperação Técnica deverá ser firmado entre as duas instituições para reinício das atividades

Fiocruz Amazônia disponibiliza podcasts sobre importância da vacinação em territórios ribeirinhos, quilombolas e de migrantes
Produções foram encaminhadas para as comunidades e estão disponíveis agora na página do You Tube da Fiocruz Amazônia

Fiocruz Amazônia divulga resultado da etapa única do processo seletivo para concessão de bolsa de Pós-Doutorado Estratégico
O resultado final do Processo Seletivo será divulgado no dia 09/04/2024.

Fiocruz Amazônia disponibiliza banco de currículo para cadastro de alunos de Iniciação Científica
Cadastre seu currículo para trabalhar em projetos da Instituição.

Centro de Estudos da Fiocruz Amazônia abordará “quimioterapia de malária”
A palestra irá apresentar algumas técnicas realizadas durante a triagem de compostos para malária.

Fiocruz Amazônia lança edital para seleção de bolsistas de Iniciação Científica
As inscrições iniciam nesta quarta-feira, 3/4, e encerram no dia 26/4/2024.

Divulgada 2ª republicação e cronograma de entrevista do processo seletivo para concessão de bolsa de Pós-Doutorado Estratégico
Confira as alterações e cronograma de entrevistas aqui.

Divulgado resultado da homologação de inscrições do processo seletivo para o ProfSaúde
Confira a lista das inscrições homologadas.

Fiocruz Amazônia divulga resultado das inscrições no processo seletivo para bolsa de Pós-Doutorado Estratégico
Confira aqui a lista das inscrições homologadas.

Novos membros do Conselho Deliberativo do ILMD/Fiocruz Amazônia são empossados para o biênio 2024/2026
Eleição ocorreu no dia 20/03 e foi homologado pela Resolução nº 007/2024, de 21 de março. Foram empossados os membros do Conselho Deliberativo representantes dos servidores nas áreas de Gestão, Ensino e Pesquisa.

OBSMA leva Projeto Escola Olímpica para comunidade indígena Três Unidos e participa de encerramento do Projeto GARI
Fiocruz Amazônia, por meio da Coordenação Norte da OBSMA, desenvolveu atividades visando incentivar a participação de professores e alunos indígenas na 12ª edição da Olimpíada

Fiocruz Amazônia realiza formação de comunicadores populares que levarão conhecimento científico para os bairros de Manaus com o Projeto Moetá
Curso foi ministrado pelo Serviço Amazônico de Ação, Reflexão e Educação Socioambiental (SARES)

Olimpíada Brasileira de Saúde e Meio Ambiente (OBSMA) participa da Romaria das Águas no Dia Mundial da Água em Manaus
Importância das bacias amazônicas é um dos temas que podem ser trabalhados em projetos de alunos e professores inscritos na 12a edição da OBSMA, que acontece este ano.

Fiocruz Amazônia apresenta pesquisa sobre monitoramento da qualidade da água de municípios amazonenses em workshop da Sema
Atividades do projeto foram apresentadas pela coordenadora da pesquisa e chefe do Núcleo de Bacteriologia, do Laboratório DMAIS, Luciete Almeida

Fiocruz Amazônia reafirma e dialoga com o CMA para realização de pesquisas em áreas de atuação do Exército
Reunião contou com representantes do Núcleo de Estudos Estratégicos do CMA, da Inspetoria de Saúde da 12ª Região Militar, Centro de Instrução de Guerra na Selva (CIGS), 2º Grupamento de Engenharia e 1º Batalhão de Infantaria de Selva (BIS)

Fiocruz Amazônia divulga 1ª republicação do processo seletivo para bolsa de Pós-Doutorado Estratégico
Republicação apresenta alterações nos anexos I e IV (cronograma e modelo do plano de atividades).

PPGBIO-Interação divulga retificação do resultado para vagas de aluno especial
Confira a retificação do resultado final, conforme listagem republicada.

Fiocruz Amazônia realiza primeiro Centro de Estudos do ano com o tema “Saúde Mental na Pós-Graduação”, próxima sexta-feira, 22/03
Objetivo será debater com os discentes da instituição (veteranos e novos) aspectos que envolvem a questão do adoecimento e do sofrimento mental durante processo de formação do Mestrado e Doutorado

Fiocruz Amazônia realiza reunião de interação entre alunos e coordenação do DASPAM dentro da programação de Abertura do Ano Letivo
Encontro foi conduzido pelos professores-doutores Júlio César Schweickardt, da Fiocruz Amazônia; e Sâmia Miguez, da UEA, e serviu para orientar, apresentar sugestões e esclarecer dúvidas dos mais de 30 alunos, do curso de Doutorado em Saúde Pública na Amazônia

VDPI se reúne para discutir reformulações e novos fluxos de processos e procedimentos
Finalidade é promover um alinhamento de informações e procedimentos buscando otimizar a operacionalização de processos que tramitam pela Vice-Diretoria de Pesquisa e Inovação

Oficina de Redação Científica traz abordagem reflexiva e crítica para a produção de artigos científicos
Curso foi uma iniciativa do Programa de Pós-Graduação em Biologia da Interação Patógeno Hospedeiro (PPGBIO-INTERAÇÃO), com apoio da CAPES

Fiocruz Amazônia divulga lista de selecionados para vagas de aluno especial do PPGBIO 2024
Será permitida a matrícula em até 2 (duas) disciplinas que perfaçam no máximo 5 (cinco) créditos

Fiocruz Amazônia tem pesquisadores aprovados no edital da Bolsa de Produtividade em Pesquisa do CNPq
Bolsa Produtividade em Pesquisa é destinada aos pesquisadores que se destaquem entre seus pares, valorizando sua produção científica, segundo critérios normativos, estabelecidos pelo CNPq, e específicos pelos Comitês de Assessoramento

Palestra sobre os direitos da mulher marca o 8 de março na Fiocruz Amazônia
Palestrante foi a juíza da 8ª Vara Criminal de Manaus, Patrícia Macedo de Campos, que falou sobre o tema “Direitos da mulher: abordando assédios moral e sexual e Lei Maria da Penha”

Fiocruz Amazônia realiza workshop para apresentar serviços e estrutura dos cursos de pós-graduação
Momento permitiu interação dos novos alunos com as coordenações dos programas de pós-graduação e com os veteranos

Diretora da Fiocruz Amazônia recebe Diploma Mulher Cidadã Amazonense em sessão especial na Assembleia Legislativa
Sessão Especial homenageou várias mulheres com atuação destacada em áreas diversas no Estado do Amazonas.

Fiocruz Amazônia participa de articulação para criação de GT Saúde junto ao Mosaico de Áreas Protegidas do Baixo Rio Negro visando fortalecer ações prioritárias de saúde para as populações do território
MosaIco abrange aproximadamente 7,5 milhões de hectares, do território de nove municípios (Barcelos, Coari, Codajás, Iranduba, Manacapuru, Manaus, Maraã, Novo Airão e Presidente Figueiredo), nas margens direita e esquerda do Rio Negro

Fiocruz Amazônia realiza capacitação para servidores e colaboradores em processos de compras com base na Lei 14.133/2021
Curso é uma das ações contidas no Plano de Capacitação, que visa qualificar o maior número de pessoas na instituição em processos de compras com base na nova lei de licitação e contratos

Fiocruz Amazônia promove curso de ‘Redação Científica’ com o professor Gilson Volpato para os alunos dos programas de pós-graduação
A oficina é uma iniciativa do Programa de Pós-Graduação em Biologia da Interação Patógeno Hospedeiro (PPGBIO-Interação), voltada para os alunos dos programas de pós-graduação do ILMD/Fiocruz Amazônia,

Seminário Saúde e Meio Ambiente na Amazônia encerra com carta à ministra Nísia Trindade e recomendações para a melhoria da qualidade da saúde na região
Na documento, instituições participantes destacam importância do momento atual para a implementação de uma agenda transformadora para a Amazônia

Ministério da Saúde prestigia lançamento de livro com resultados do Projeto Manaós no Parque das Tribos
Projeto fez uma análise da capacidade de acesso das famílias indígenas à rede de serviços de saúde da capital, exatamente no período de pico pandêmico da Covid-19

Fiocruz Amazônia recebe evento sobre Política de Equidade, Inclusão e Ações Afirmativas
A Cedipa foi criada, em março de 2023, com o objetivo de implementar ações que assegurem a efetivação das políticas institucionais da Fiocruz para equidade, diversidade, inclusão e políticas afirmativas

Fiocruz Amazônia apresenta estudo sobre esporotricose em audiência pública sobre a doença
Pesquisa é financiada pela Fundação de Amparo à Pesquisa do Estado do Amazonas (Fapeam) e CNPQ, com previsão de ser concluída em 2025

Fiocruz Amazônia abre processo seletivo para bolsa de Pós-Doutorado Estratégico
Objetivo é o de integrar um pesquisador às atividades vinculadas às Linhas de Pesquisa do Programa de Pós-Graduação em Biologia da Interação Patógeno Hospedeiro (PPGBIO-Interação)

Fiocruz Amazônia inicia matrícula dos classificados ao Mestrado do PPGBIO-Interação na próxima segunda-feira, 19/02
De acordo com a Chamada Pública 002/2024, as matrículas serão efetivadas entre os dias 19/02 e 23/02/2024

Fiocruz Amazônia inicia matrícula dos classificados ao Doutorado do PPGBIO-Interação na próxima segunda-feira, 19/02
Documentação necessária deve ser encaminhada, a partir da próxima segunda-feira, 19/02, para o ingresso no primeiro semestre de 2024

PPGBIO-Interação abre inscrições com oferta de vagas para aluno especial
As inscrições ocorrem até a próxima quarta-feira, 21/2. A seleção dos candidatos ocorrerá no período de 23 a 27/02/2024

Editais do Programa Pró-Infra, da Finep, são apresentados à Fiocruz Amazônia
o edital tem por objetivo fomentar a pesquisa no país, por meio da compra de equipamentos e sua modernização, aumentando a capacitação dos parques brasileiros

Fiocruz Amazônia apresenta proposta de projeto à Semsa Manaus voltado às populações da zona ribeirinha
Iniciativa tem por objetivo promover a construção coletiva de políticas públicas de saúde, por meio de tecnologias sociais.

Stefanie Lopes é empossada diretora da Fiocruz Amazônia
O início de um novo ciclo, com as comemorações dos 30 anos de criação da Fiocruz Amazônia, que serão celebrados neste ano, também fizeram parte do discurso de posse da nova diretora.

Fiocruz Amazônia prestigia inauguração da Unidade de Saúde da Família Parque das Tribos
A entrega da unidade de saúde marcou também o encerramento das atividades do Projeto Manaós da Fiocruz Amazônia,
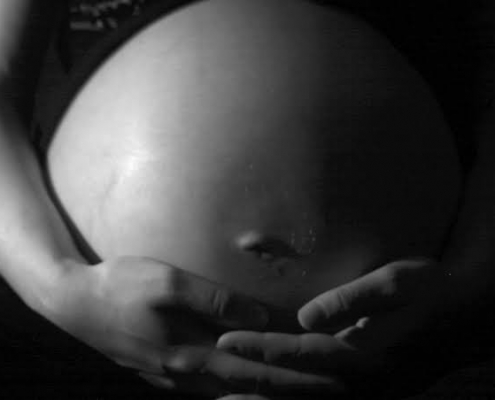
Fiocruz avalia o excesso de mortes maternas durante os dois primeiros anos da epidemia de Covid-19 no Brasil
Excesso de mortes maternas foi de 69% no Brasil, com 39% no primeiro ano e 100% de aumento no segundo ano.

Manicoré recebe produtos de comunicação do Projeto Amazônia Solidária
Devolutivas do projeto estão sendo realizadas com a entrega dos materiais às comunidades em territórios ribeirinhos, quilombolas e de migrantes

Doutorado em Saúde Pública na Amazônia realiza reunião do colegiado para autoavaliação e elege nova coordenação para o quadriênio 2024-2028
O encontro teve como objetivo também avaliar o desempenho do DASPAM, nos seus primeiros quatro anos de atuação.

Fiocruz Amazônia realiza evento visando reunir contribuições para discussão sobre Saúde e Ambiente na COP-30
A escolha dos eixos temáticos foi feita a partir das atividades desenvolvidas no ILMD/Fiocruz Amazônia.

Com 11 vagas para Manaus, concurso da Fiocruz abre inscrições nesta segunda-feira, 22/1
Os salários variam de R$ 5.735,29 (analista de gestão e tecnologista) e R$ 6.463,37 (pesquisador), podendo chegar a R$ 13.686,72.

Comunidades começam a receber produtos de comunicação em saúde do Projeto Amazônia Solidária, desenvolvido pela USAID e Fiocruz Amazônia
Produtos passam a ser utilizados no dia a dia das comunidades, com mensagens de estímulo à vacinação. Entrega marca o encerramento do projeto Amazônia Solidária

Fiocruz Amazônia propõe aplicação de ferramentas matemáticas e estatísticas com aplicação em análises epidemiológicas de eventos incomuns em saúde
Curso contou com o apoio do Proep-Labs do ILMD/Fiocruz Amazônia (2023-2025) e aconteceu entre os dias 08 e 09/01, ministrado por Erick A. Chacón Montalván, doutor em Estatística e Epidemiologia pela Lancaster University (Inglaterra)

Fiocruz Amazônia recebe visita dos alunos do Curso Colaborativo em Saúde Pública da Universidade de Harvard
Iniciativa é realizada em parceria pela Escola de Saúde Pública de Harvard TH Chan (HSPH), Programa Brasil da Universidade de Harvard Centro David Rockefeller de Estudos Latino Americanos e Universidade do Estado do Amazonas

Vice-Diretoria de Gestão e Desenvolvimento Institucional do ILMD/Fiocruz Amazônia realiza Reunião Anual para Avaliação de Resultados
Evento reuniu líderes, gestores e colaboradores das diversas áreas que compõem a VDGI para analisar e discutir os resultados alcançados ao longo do ano.

Fiocruz Amazônia implantará Núcleo de População em Situação de Rua para atuação em favor desse segmento em Manaus
Iniciativa é vinculada ao Colaboratório Nacional de População em Situação de Rua, criado pela Fiocruz Brasília, em parceria com a Frente Parlamentar Pop Rua do Congresso Nacional e os Ministérios dos Direitos Humanos e Cidadania (MDHC), da Saúde (MS) e da Justiça e Segurança Social

Fiocruz Amazônia divulga resultado final da 2ª Etapa do Processo Seletivo para ingresso no curso de Doutorado do PPGBIO Interação
confira aqui a classificação final da segunda etapa do processo seletivo.

Divulgado resultado dos pedidos de recurso da 2ª Etapa do Processo Seletivo para ingresso no curso de Doutorado do PPGBIO Interação
confira aqui os pedidos de recurso deferidos.

Fiocruz Amazônia divulga resultado definitivo do Processo Seletivo do Mestrado do PPGVIDA – Turma 2024
Confira o resultado do processo seletivo

Fiocruz Amazônia divulga resultado preliminar do processo seletivo de candidatos para curso de mestrado do PPGBIO-Interação
Confira a classificação preliminar dos candidatos aprovados no processo seletivo.

Divulgado resultado definitivo da 4ª etapa do processo seletivo de candidatos para curso de mestrado do PPGBIO-Interação
Confira aqui o resultado preliminar da análise curricular.

Divulgado resultado definitivo da 3ª etapa do processo seletivo de candidatos para curso de mestrado do PPGBIO-Interação
Confira o resultado da 3ª etapa, após análise de recurso.

Fiocruz Amazônia divulga classificação preliminar do Processo Seletivo para curso de Doutorado do PPGBIO Interação
Confira aqui a classificação preliminar.

Divulgado resultado da análise do Currículo Lattes referente à 3ª Etapa do Processo Seletivo para curso de Doutorado do PPGBIO Interação
Confira aqui o resultado.

Divulgado resultado da Prova Oral referente à 2ª Etapa do Processo Seletivo para curso de Doutorado do PPGBIO Interação
Confira aqui o resultado

Pesquisadora da Fiocruz Amazônia participa de solenidade de premiação da CAPES em Brasília
No total, concorreram 1.469 teses de doutorado, o maior número de participantes da história da premiação.

Fiocruz Amazônia apresenta devolutiva de projeto Modernização de laboratório de pesquisa financiado pela FINEP
A iniciativa teve foco no fortalecimento da infraestrutura das instituições de pesquisa científica e tecnológica sediadas e com atuação específica na região que compreende a Amazônia Legal.

PPGVIDA divulga resultado das notas do Currículo Lattes, referente ao Processo de seleção de candidatos
Confira aqui a lista dos aprovados

PPGVIDA divulga resultado definitivo das inscrições, após análise dos pedidos de recurso
Confira as inscrições homologadas

Divulgada 1ª republicação para processo seletivo do Curso de Mestrado do PPGBIO-Interação
republicação aponta alterações no Anexo I e no Anexo XI

Comissão Eleitoral da Fiocruz Amazônia divulga nome de candidata inscrita para o cargo de Diretora
A análise dos recursos ocorrerá entre os dias 31/10 e 1/11. O resultado dos recursos será divulgado ainda no dia 1/11.

Fiocruz Amazônia prorroga até 27/10 prazo para inscrições ao Mestrado em Condições de Vida e Situações de Saúde na Amazônia
O PPGVIDA é o mais antigo dos cursos de pós-graduação oferecidos pelo ILMD/Fiocruz Amazônia, com a primeira turma formada em 2015

Fiocruz Amazônia participa de oficina que debate cadeias estratégicas para a Amazônia Legal
O debate pretende contribuir com a definição e priorização de cadeias estratégicas, no âmbito da Iniciativa Amazônia +10.

Fiocruz Amazônia promove ciclo de atividades de popularização científica na 20ª Semana Nacional de Ciência e Tecnologia
As atividades seguem até sexta-feira (20/10)

Inscrições para processo seletivo do Curso de Mestrado Acadêmico em Condições de Vida e Situações de Saúde na Amazônia encerram nesta sexta-feira, 20/10
Para esta Chamada Pública, estão sendo oferecidas 19 (dezenove) vagas

Fiocruz Amazônia leva atividades práticas para estudantes do Campus Tabatinga do IFAM na Semana Nacional de Ciência e Tecnologia
A programação teve início na segunda-feira, 16/10, com a solenidade de abertura do Encontro de Pesquisa e Extensão do IFAM, que acontece junto com a SNCT 2023.

Em Manaus, Ministra da Saúde autoriza portarias que liberam R$ 110,4 milhões para emergências em saúde no AM
Segundo a titular da Saúde, o governo federal ainda vai investir R$ 122.793.162 mensalmente, a partir de novembro deste ano, para dar continuidade à recuperação permanente dos programas de saúde no Estado.

Inscrições abertas para o cargo de diretor(a) da Fiocruz Amazônia – Biênio 2023/2025
O período de inscrição dos candidatos inicia nesta terça-feira, 17/10.

Fiocruz Amazônia lança chamada pública para cursos de mestrado e doutorado do Programa de Pós-Graduação Stricto Sensu em Biologia da Interação Patógeno Hospedeiro
Candidatos interessado devem atentar para período de solicitação das taxas de isenção no processo seletivo.

Fiocruz Amazônia apresenta startups de saúde na Campus Party
É a primeira vez que a Fiocruz Amazônia submete ao CPA projetos de plataformas desenvolvidos com a finalidade de contribuir para a melhoria da Saúde Pública
 https://amazonia.fiocruz.br/wp-content/uploads/2023/10/IMG_4306-scaled.jpg
1707
2560
Julio Oliveira
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Julio Oliveira2023-10-11 19:35:222023-10-19 11:50:57Oficinas da Fiocruz Amazônia produzem material para divulgação científica durante a Semana Nacional de Ciência e Tecnologia no Amazonas
https://amazonia.fiocruz.br/wp-content/uploads/2023/10/IMG_4306-scaled.jpg
1707
2560
Julio Oliveira
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Julio Oliveira2023-10-11 19:35:222023-10-19 11:50:57Oficinas da Fiocruz Amazônia produzem material para divulgação científica durante a Semana Nacional de Ciência e Tecnologia no Amazonas
Divulgado o resultado dos pedidos de isenção para processo seletivo do PPGVIDA
Confira a lista de pedidos deferidos.

Divulgada 1ª Republicação para processo de seleção pública para Mestrado Acadêmico em Condições de Vida e Situações de Saúde na Amazônia
Para esta Chamada Pública, estão sendo oferecidas 19 (dezenove) vagas para ingresso no ano de 2024.

Fiocruz Amazônia divulga edital para Eleição de Diretor(a) Biênio 2023/2025
Processo eleitoral inicia nesta sexta-feira, 6/10.

Pesquisador da Fiocruz Amazônia aponta fatores sociais como importante causa para o excesso de suicídios no Brasil
Jesem Orellana foi um dos palestrantes do 3º Simpósio Prevenção é a Solução promovido pela Frente Parlamentar de Cuidados e Prevenção à Depressão, Suicídio e Drogas da Assembleia Legislativa do Estado do Amazonas

Fiocruz Amazônia abre inscrições para processo seletivo do Curso de Mestrado Acadêmico em Condições de Vida e Situações de Saúde na Amazônia
Para esta Chamada Pública, estão sendo oferecidas 19 vagas para ingresso no ano de 2024

Palestra apresentará resultados de estudos sobre transmissão do Zika vírus, infecção em gestantes e Síndrome de Zika congênito
O Centro de Estudos do ILMD/Fiocruz Amazônia é um núcleo que oportuniza encontros, palestras, seminários e debates sobre diversos temas ligados à pesquisa e ao ensino para a promoção da saúde.

Estudo aponta aumento das taxas de suicídio entre jovens indígenas da regiões Norte e Centro-Oeste
Pesquisadores da Fiocruz e da Universidade de Harvard analisaram dados de mortalidade do Ministério da Saúde entre 2000 e 2020

Fundo de População das Nações Unidas e Fiocruz Amazônia lançam curso online sobre Manejo Clínico da Violência Sexual
Serão disponibilizadas 1.000 vagas para trabalhadores da saúde que atuam no atendimento a vítimas na Região Norte

Obras da nova sede da Fiocruz Amazônia estão previstas para começar no segundo semestre do ano que vem
Cronograma atualizado da obra foi apresentado pelo diretor executivo da Fiocruz, Juliano de Carvalho Lima, e a diretora interina do ILMD;/Fiocruz Amazônia, Stefanie Lopes, ao Comando do 2o Grupamento de Engenharia do Exército

Fiocruz realiza 2º Seminário Internacional do Programa VigiFronteiras-Brasil e aborda estratégias de Vigilância em Saúde nas regiões de fronteira
Evento acontece no dia 25 de setembro, às 10h (BRT), e será transmitido pelo Canal da VideoSaúde Distribuidora da Fiocruz no YouTube

Adele Benzaken deixa o cargo de diretora da Fiocruz Amazônia após dois anos de gestão
Anúncio foi feito em reunião extraordinária do Conselho Deliberativo do ILMD/Fiocruz Amazônia

Fiocruz Amazônia abre inscrições para oficina de divulgação científica por meio de vídeos e podcasts
As atividades fazem parte das ações promovidas pela Fiocruz Amazônia, e darão início a Semana Nacional de Ciência e Tecnologia 2023 – SNCT 2023

Programa de Iniciação Científica da Fiocruz Amazônia realiza semana de adaptação para novos bolsistas
O Programa de Iniciação Científica da Fiocruz Amazônia tem como objetivos despertar a vocação científica e incentivar novos talentos potenciais entre estudantes de graduação.

Pesquisa desenvolvida na Fiocruz Amazônia vence Prêmio CAPES de Tese de 2023
Tese que busca por novos insumos e métodos para o diagnóstico de malária, sob orientação de Luis André Morais Mariúba, pesquisador do Laboratório de Diagnóstico e Controle de Doenças Infecciosas na Amazônia (DCDIA), concorreu com 1.469 trabalhos de todo país.

Nova coordenação discute planejamento de atividades do Programa de Iniciação Científica da Fiocruz Amazônia
A reunião visou promover a integração, planejamento de atividades, desenvolvimento de calendário, estratégias e ações, envolvendo pesquisadores e demais colaboradores responsáveis pela execução do Programa.

Fiocruz Amazônia participa de audiência pública sobre medicina de matrizes africanas e indígenas na Câmara dos Deputados, em Brasília (DF)
A audiência debateu a criação de um Dia da Medicina Tradicional Africana, além de discutir sobre o papel fundamental que a medicina tradicional desempenha.

Fiocruz Amazônia promove seminário para planejar e discutir futuro das pesquisas em saúde e políticas públicas na Amazônia
O LAHPSA atua no apoio aos sistemas locais de saúde e aos movimentos sociais, sobretudo os povos tradicionais da Amazônia.

Estudo sobre Potencial biotecnológico de microrganismos para controle populacional de mosquitos será apresentado durante Centro de Estudos da Fiocruz Amazônia
A palestra fará uma abordagem sobre a prospecção de microrganismos para implementação de novos agentes entomopatogênicos.

Fiocruz Amazônia é homenageada durante sessão especial da ALE-AM pelos 68 anos da Fundação Alfredo da Matta
Adele Schwartz Benzaken, que foi diretora-presidente da FUHAM, recebeu o certificado em homenagem à parceria entre as duas instituições.

Aniversário da Fiocruz Amazônia conta com apresentação do balanço dos dois anos de gestão da diretora Adele Benzaken
A apresentação fez parte da programação de aniversário de 29 anos da instituição.

Protocolo da Fiocruz para detecção do vírus Oropouche é referência para laboratórios brasileiros e de outros países da Américas
A adoção desse ensaio visa ampliar a oferta diagnóstica para a prevenção do surgimento de doenças com potencial para se transformar em epidemias ou pandemias.

Fiocruz Amazônia realiza estudo de avaliação do perfil clínico-epidemiológico em pacientes com suspeita de filariose por espécies de Mansonella na Tríplice Fronteira amazônica na região do Alto Solimões
Os municípios de Tabatinga, Lábrea e São Gabriel da Cachoeira são os que mais registram casos de filariose por Mansonella no Amazonas.

Oficinas levam comunidades a pensar produtos de comunicação em favor da saúde pública
Roteiros, vídeos, flyers, podcasts, rodas de conversa, faixas, cartazes, repentes e paródias nasceram a partir das estratégias e necessidades de saúde das comunidades ribeirinhas, quilombolas e de migrantes por meio do Projeto Amazônia Solidária

Projeto de educação ambiental da Fiocruz Amazônia monitora qualidade da água em comunidades rurais de municípios amazonenses
Ao longo de 18 meses, o projeto já percorreu 11 dos 12 municípios contemplados e gerou laudos de análises realizadas na água coletada nas comunidades

Projeto da Fiocruz Amazônia e USAID incentiva a comunicação em saúde e fortalece cobertura vacinal em Barcelos
No total, 64 profissionais participaram da oficina e elaboraram produtos de comunicação capazes de multiplicar informações, divulgar ações da Saúde e sensibilizar a comunidade.

Fiocruz Amazônia realiza evento de acolhida e apresenta nova coordenação do Programa de Iniciação Científica
O programa institucional visa a formação de recursos humanos para a pesquisa em saúde e, o desenvolvimento científico de jovens estudantes de graduação de Instituições de Ensino Superior .

Fiocruz Amazônia e Associação dos Venezuelanos no Amazonas articulam parceria em prol da saúde de mulheres migrantes
A visita foi marcada também pela entrega de doações, arrecadadas na Fiocruz Amazônia, durante a realização da campanha “Dignidade Menstrual”.

Palestra do Centro de Estudos da Fiocruz Amazônia vai abordar “Epidemiologia da leptospirose urbana”
Na oportunidade, serão apresentados estudos ecoepidemiológicos dos reservatórios de ratos e do meio ambiente, juntamente com estudos prospectivos de longo prazo de uma coorte de moradores de favelas da cidade de Salvador, no Brasil.

Fiocruz Amazônia realiza Aula Inaugural do Mestrado em Saúde Coletiva para indígenas do Alto Solimões
O processo seletivo reuniu tikunas, kambebas, kaikanas, marubos, kokamas e kanamaris, dos municípios de Tabatinga, Benjamim Constant, Atalaia do Norte, Amaturá e Santo Antônio do Içá.

Estudo da Fiocruz confirma excesso de suicídios durante a pandemia de Covid-19 no Brasil
O estudo reforça que países severamente atingidos pelos efeitos diretos da pandemia como o Brasil, foram mais propensos aos seus efeitos indiretos sobre outras causas de morte, como o suicídio e as mortes maternas, por exemplo.

CD homenageia pesquisadores condecorados com a Ordem Nacional do Mérito Científico
Criada em 1993, a Ordem Nacional do Mérito Científico reconhece contribuições científicas e técnicas de pesquisadores brasileiros e estrangeiros.

Servidores aprovam novo Regimento Interno da Fiocruz Amazônia
A assembleia foi presidida pela diretora do ILMD/Fiocruz Amazônia, Adele Benzaken, e contou com representantes de todos os setores da instituição.

Fiocruz Amazônia faz pré-lançamento de livro sobre Saúde Indígena nas Cidades no Diálogos Amazônicos com base na experiência do Projeto Manaós
O Diálogos Amazônicos é evento prévio da Cúpula da Amazônia, que acontecerá entre os dias 8 e 9/08, na capital paraense.

Centro de Estudos vai apresentar resultados do estudo de implementação de tafenoquina para cura radical de malária vivax na Amazônia brasileira
A pesquisa acompanhou implementação de ferramentas em unidades de referência de alta complexidade, unidades de urgência e emergência, unidades básicas de saúde e postos de diagnóstico de malária nas cidades de Manaus (AM) e Porto Velho (Rondônia).
Doutorando em Saúde Pública da Fiocruz Amazônia passa a integrar coordenação do GT de Avaliação em Saúde da Abrasco
Victor Aquino foi escolhido para coordenação e aceito pelos membros por ser aluno de doutorado e fazer a Interlocução com estudantes de graduação, mestrado e doutorado para o tema avaliação em Saúde.

Fiocruz Amazônia convoca para matrícula institucional os candidatos aprovados no processo seletivo para Mestrado em Saúde Coletiva exclusivo para candidatos indígenas do Alto Solimões
Para realizar a matrícula institucional, o candidato classificado, ou seu procurador, deverá comparecer, nos dias 14 e 15 de agosto de 2023, na Universidade do Estado do Amazonas - UEA, sala da coordenação de licenciatura intercultural indígena, Tabatinga – AM.

Divulgado resultado das entrevistas e resultado preliminar do processo seletivo para Mestrado em Saúde Coletiva exclusivo para candidatos indígenas do Alto Solimões
Foram aprovados e classificados, 15 candidatos(as) e 4 suplentes.

Divulgado novo cronograma para processo seletivo do Mestrado em Saúde Coletiva exclusivo para candidatos indígenas do Alto Solimões
A republicação estabelece alterações no cronograma do processo seletivo.

Fiocruz Amazônia convoca aprovados em Curso de Doutorado em Saúde Pública na Amazônia para matrícula institucional
As matrículas ocorrem entre os dias 01 e 02/08/2023.

Fiocruz Amazônia retoma seu Sistema de Gestão da Qualidade (SGQ) com a reestruturação da Assessoria de Gestão da Qualidade
O trabalho se iniciará com o mapeamento dos processos administrativos e fluxos, a fim de enxergar como estão funcionando e visualizar as oportunidades de melhoria.

Ministra da Saúde exalta papel dos cientistas homenageados com a Ordem Nacional do Mérito Científico pela luta em favor das instituições democráticas e da pesquisa
A ministra fez a referência aos cientistas citando-os como exemplos da luta e do desrespeito sofridos pelas instituições de ensino e pesquisa no País ao longo dos últimos quatro anos.

Projeto Amazônia Solidária realiza oficina final reunindo experiências e produtos de comunicação em saúde
O objetivo foi o de reunir trabalhos na área de Comunicação em Saúde, produzidos pelas comunidades de territórios ribeirinhos, quilombolas e de migrantes

Vice-presidente de Pesquisa e Coleções Biológicas e coordenadora de Vigilância e Laboratórios de Referência da Fiocruz visitam o ILMD/Fiocruz Amazônia
Durante a visita ao ILMD, a vice-presidente de Pesquisa e a coordenadora de Vigilância e Laboratórios de Referência percorreram as instalações da sede da instituição

Fiocruz Amazônia apresenta resultados do trabalho de vigilância de patógenos em workshop da OMS/OPAS em Manaus
. O trabalho foi apresentado durante a Oficina Técnica sobre Vigilância Regional de Patógenos Emergentes e Zoonóticos com Potencial Epidêmico e Pandêmico

Centro de Estudos vai abordar consumo alimentar e, relação entre nutrição e agravos crônicos
O Centro de Estudos é um núcleo que oportuniza encontros, palestras, seminários e debates sobre diversos temas ligados à pesquisa e ao ensino para a promoção da saúde.

Fiocruz Amazônia e FVS-RCP formalizam acordos de cooperação para fortalecer vigilância em saúde no Amazonas
O foco das parcerias são as doenças infecciosas como dengue, zika, malária, Chikungunya, febre amarela, Covid-19, infecções sexualmente transmissíveis (IST/HIV/Aids) e hepatites virais.

Divulgado resultado da 3ª etapa do processo seletivo para Curso de Doutorado em Saúde Pública na Amazônia
Confira os resultados das avaliações do pré-projeto, currículo lattes e entrevista.

Fiocruz Amazônia divulga 3ª Republicação para processo seletivo do Mestrado em Saúde Coletiva exclusivo para candidatos indígenas
O período de matrículas ocorrerá entre os dias 14 e 16 de agosto, de 2023.

Presidente Lula repara erro histórico com entrega de medalhas da Ordem Nacional do Mérito Científico a pesquisadores que tiveram condecoração revogada em 2021
A Ordem Nacional do Mérito Científico é concedida como forma de reconhecimento pelas contribuições científicas e técnicas dadas por personalidades nacionais e internacionais para o desenvolvimento da Ciência no Brasil.

Prêmio Oswaldo Cruz de Teses prorroga inscrições até 14/7
Prêmio reconhece e valoriza os esforços educacionais de seus servidores e servidoras, destacando trajetórias acadêmicas de elevado mérito na educação no campo da saúde

Presidente Lula entrega medalhas da Ordem Nacional do Mérito Científico a Adele Benzaken e Marcus Lacerda
A entrega ocorrerá durante a sessão solene de instalação do Conselho Nacional de Ciência e Tecnologia, a partir das 9h30h (horário Brasília).

PPGBIO-Interação divulga nova republicação sobre oferta de vagas para aluno especial
As inscrições ocorrem até a próxima sexta-feira, 14/7.

Pesquisador da Fiocruz Amazônia aborda “Inovação aplicada à saúde” durante o Amazon Health Tech Conference
Palestra abordou histórico da atuação do NIT nos últimos dez anos, além de apresentar as tecnologias que foram depositadas pelo Instituto.
 https://amazonia.fiocruz.br/wp-content/uploads/2023/07/18d1e90f-6cb6-4142-8afe-62f3735b528d.jpg
1066
1600
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2023-07-07 10:25:092024-10-25 10:27:41Fiocruz Amazônia integra projeto do Instituto Francês de Pesquisa para o Desenvolvimento na área de vigilância de doenças infecciosas naTríplice Fronteira
https://amazonia.fiocruz.br/wp-content/uploads/2023/07/18d1e90f-6cb6-4142-8afe-62f3735b528d.jpg
1066
1600
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2023-07-07 10:25:092024-10-25 10:27:41Fiocruz Amazônia integra projeto do Instituto Francês de Pesquisa para o Desenvolvimento na área de vigilância de doenças infecciosas naTríplice Fronteira
Parceria entre Fiocruz e USAID capacita equipes, aumenta oferta diagnóstica e ajuda a reduzir tempo de respostas dos laboratórios de saúde pública na Amazônia
Os treinamentos ocorreram entre os meses de outubro e novembro de 2022, mas, para Kayser, a experiência tem reflexos positivos até hoje.

Centro de Estudos vai abordar o tema “Modelagem Matemática na Epidemiologia: Explorando Estudos Recentes e Conquistas Alcançadas”
Na palestra, serão abordados os conhecimentos atuais e os principais objetivos da modelagem matemática aplicada à epidemiologia de doenças infecciosas.

“As pessoas passam a conversar sobre a importância da vacina”
Pesquisador faz um balanço do impacto obtido com o trabalho e destaca a importância das parcerias para o atingimento de metas ousadas, com barreiras geográficas a serem vencidas e o desafio de formar equipes de campo para chegar até as comunidades.

Fiocruz Amazônia tem alunos do PPGBIO aprovados no Programa de Mobilidade Acadêmica 2023 da Fiocruz
O objetivo do Programa de Mobilidade Acadêmica é selecionar discentes de programas de mestrado acadêmico, mestrado profissional, doutorado acadêmico ou doutorado profissional da Fundação que tenham interesse em desenvolver projetos de pesquisa em unidades ou escritórios da Fiocruz distintas daquelas nas quais estão regularmente associados.

Programa de Vocação científica prorroga inscrições até 14/7
Confira novo prazo para inscrições no Programa de Vocação Científica - etapa 2023/2024.

Doutorado em Saúde Pública na Amazônia oferece bolsa de pós-doutorado
O projeto desenvolvido deverá se inserir em projeto da referida linha de pesquisa, envolvendo aspectos epidemiológicos da saúde de populações rurais ribeirinhas.

Fiocruz Amazônia estuda impacto do desmatamento na diversidade e nos ciclos de transmissão de parasitos tripanossomatídeos, como os causadores da Doença de Chagas e Leishmaniose
Sapos, lagartos, cobras, roedores e gambás podem estar sendo reservatórios do parasita e integrando o ciclo de transmissão das doenças em área de desflorestamento com presença de humanos

Fiocruz Amazônia é parceira do XI Simpósio Nacional de Geografia da Saúde 2023
Os trabalhos podem ser submetidos até 10 de agosto.

Fiocruz Amazônia divulga cronograma de entrevistas do processo seletivo para curso de doutorado em saúde pública na Amazônia
As entrevistas acontecem até o dia 29/6.

Fiocruz Amazônia participa de XX Congresso Mundial de Sociologia na Austrália
O projeto foi realizado em parceria com o Fundo das Nações Unidas para Infância (UNICEF) e a Coordenação das Organizações Indígenas da Amazônia Brasileira (COIAB).

Fiocruz Amazônia realiza circuito de palestras e oficinas para o Mais Meninas na Fiocruz 2023
O objetivo do projeto é estimular que cada vez mais meninas e jovens mulheres estudantes de escolas e universidades tenham a oportunidade de vivenciar a produção de Ciência e Tecnologia

Fiocruz Amazônia e CIGS retomam atividades de pesquisa sobre presença de patógenos em fauna silvestre
. Um novo acordo de cooperação deverá ser firmado entre as duas instituições para viabilização das pesquisas.

Centro de Estudos da Fiocruz Amazônia vai abordar desafios da vigilância das paralisias flácidas agudas em tempos de não pólio no Brasil
Palestra é destinada a estudantes de graduação e pós-graduação, pesquisadores, professores e trabalhadores da área da Saúde.

Fiocruz Amazônia está com inscrições abertas até 30/06 para processo seletivo do Mestrado em Saúde Coletiva exclusivo para candidatos indígenas
O curso terá duração mínima de 12 meses e máxima de 24 meses, incluindo a realização da defesa e dissertação.

Fiocruz Amazônia e Universidade de Washington desenvolvem projeto para fortalecer vigilância em saúde na região da Tríplice Fronteira
O projeto contará com financiamento do Centro de Controle e Prevenção de Doenças (CDC-EUA), para o desenvolvimento de ações conjuntas entre os países

Projeto da Fiocruz Amazônia voltado para saúde ribeirinha realiza o mapeamento colaborativo da comunidade Santa Maria
As prioridades escolhidas serão ponto de partida para a construção do plano de ação a ser desenvolvido pelos próprios comunitários.

Fiocruz Amazônia recebe comitiva da Universidade de Pittsburgh para fortalecer estudos sobre a Amazônia
A ideia é promover seminários conjuntos e oferecer oportunidades de intercâmbio para alunos, professores e pesquisadores das instituições envolvidas.

Programa de Mobilidade Acadêmica 2023: confira errata com novas orientações e cronograma
Com o novo cronograma, o prazo para envio de propostas vai até 15 de junho.

Divulgado resultado do processo seletivo para Programa de Iniciação Científica da Fiocruz Amazônia
Os candidatos e orientadores têm até essa terça-feira, 13/6, para encaminhar o recurso de forma virtual.

Pesquisa da Fiocruz Amazônia desenvolve modelo de governança da gestão das microrregiões do saneamento básico para o Estado do Amazonas
Dos 62 municípios amazonenses só 38 alimentam o Sistema de Informação de Saneamento Básico.

Fiocruz Amazônia recebe comitiva da USAID para discussão sobre projetos e cooperações futuras
Visita teve o objetivo de apresentar de forma mais ampliada e detalhada, projetos desenvolvidos pela Fiocruz Amazônia.

Fiocruz Amazônia inicia aulas do Mestrado em Epidemiologia Aplicada à Saúde da Mulher e da Criança na Amazônia
O curso tem como objetivo aumentar a qualificação dos profissionais para melhor instituição de programas e projetos a serem desenvolvidos no campo da saúde pública.

Prorrogada divulgação do resultado de análise técnica do processo seletivo para o Programa de Iniciação Científica da Fiocruz Amazônia
Confira alteração no cronograma do processo seletivo.

Fiocruz Amazônia participa do 1o Congresso Internacional da Associação Argentina de Saúde Pública
O evento teve como tema “Saúde única: para uma Argentina com equidade” e contou com mais de 4 mil inscritos

Fiocruz Amazônia realiza I Jornada do Programa de Vocação Científica
Evento contará com a exposição de posters, que relatam as experiências dos estudantes do Ensino Médio, da rede pública estadual de ensino do Amazonas, contemplados com bolsas do Programa.

Fiocruz Amazônia e FMT-HVD apresentam pesquisa no maior congresso de citometria de fluxo do Mundo
Estudo com pessoas vivendo com HIV/AIDS desenvolvido pelo Laboratório de Diagnóstico e Controle de Doenças Infecciosas na Amazônia (DCDIA), com apoio da CAPES e Fapeam, analisa a disfunção de linfócitos em pessoas com vários episódios de hospitalização.

Projeto desenvolvido em parceria pela Fiocruz Amazônia e USAID amplia vigilância genômica na região amazônica
O virologista da Fiocruz Amazônia, Felipe Naveca, explica que, desde 2022, a Fiocruz Amazonia tem observado a necessidade de ampliar a vigilância genômica para outros patógenos, além de COVID-19.

20ª RAIC da Fiocruz Amazônia destacará trajetórias de sucesso dos 24 anos de existência do programa de iniciação científica
Programa tem como objetivo despertar a vocação científica e incentivar novos talentos potenciais entre estudantes de graduação

Circuito de Saúde do Trabalhador realiza atividades para servidores e marca as comemorações, em Manaus, pelos 123 anos da Fiocruz
A programação se encerrou na sexta-feira, 26/05, com atividades físicas e diversos serviços oferecidos gratuitamente aos participantes.

Indígenas discutem caracterização de espaço para troca de saberes na UBS do Parque das Tribos
O Projeto Manaós: Saúde da População Indígena em Contexto Urbano” é desenvolvido pela Fiocruz Amazônia, por meio do Edital Saúde Indígena, do Programa Inova Fiocruz.

Fiocruz Amazônia realiza curso sobre diagnóstico molecular para filarioses na Amazônia
O curso é voltado para alunos de iniciação científica, mestrado e doutorado.

Fiocruz Amazônia parabeniza a Fapeam pelos 20 anos de fomento à pesquisa científica e tecnológica
A Fapeam é uma das principais fomentadoras das pesquisas realizadas pela Fiocruz Amazônia.

Projeto Manaós, da Fiocruz, se destaca entre experiências de impacto local selecionadas pelo Laboratório Latino-Americano de Práticas de Participação Social em Saúde
. O Laboratório tem como finalidade possibilitar trocas e aprendizados, além de potencializar as ações dos atores envolvidos na execução dos projetos em níveis regionais, nacional e internacional.

Pesquisadora da Fiocruz Amazônia aborda aspectos da socioambiência e dos direitos à cidadania indígena no Seminário Saúde e Ambiente na Amazônia
Garnelo cita o empreendedorismo indígena como alternativa para a questão da sustentabilidade, com dezenas de atividades desenvolvidas na busca pela geração der renda.

Fiocruz Amazônia abre inscrições de Mestrado Acadêmico em Condições de Vida e Situações de Saúde na Amazônia para candidatos indígenas do Alto Solimões
O curso, cujas vagas são oferecidas nesta Chamada Pública, ocorrerá de forma presencial e, terá sede em Tabatinga – AM.

Fiocruz Amazônia promove roda de conversa entre jovens comunicadoras indígenas do Amazonas e alunas da rede municipal de Belo Horizonte (MG)
As rodas de conversa são iniciativas que integram o Programa Mulheres e Meninas na Ciência, da Fiocruz, cujo objetivo é estimular o interesse de mais meninas e mulheres pela carreira profissional de cientista.

Fiocruz Amazônia promove II Workshop Estratégico de Pós-graduação
Encontro vai destacar o processo de integração dos discentes que ingressaram este ano, nos programas de pós-graduação da instituição.

Divulgado resultado 2ª Etapa do Processo Seletivo para Curso de Doutorado Acadêmico em Saúde Pública na Amazônia
O curso tem como objetivo capacitar pesquisadores para exercitar análises críticas, utilizando, de forma integrada, conceitos e recursos metodológicos da saúde coletiva, biologia parasitária, epidemiologia, ciências sociais aplicadas à saúde, e de outras áreas conexas

Fiocruz Amazônia defende investimentos em pesquisa e produção local para garantir acesso a medicamentos
diretora da Fiocruz Amazônia, Adele Schwartz Benzaken, defendeu uma política pública de incentivo à pesquisa e produção local de biofármacos

Centro de Estudos vai abordar desafios para implementação de plataforma de cooperação científica Internacional
A apresentação abordará questões referentes à diplomacia científica como ferramenta de diálogo entre cientistas e gestores.

Anamã desenvolve projeto em parceria com a Fiocruz Amazônia, Fiotec, USAID e Conselhos de Secretários Municipais de Saúde para fortalecer a cobertura vacinal em comunidades ribeirinhas
A primeira oficina envolveu lideranças comunitárias, trabalhadores da Secretaria Municipal de Saúde de Anamã e usuários do sistema de saúde local.

Projeto da Fiocruz Amazônia, Fiotec e USAID fortalece vacinação contra Covid-19 e aproxima serviços de saúde da população ribeirinha em Tabatinga
Em resposta às necessidades da comunidade Novo Paraíso, equipe da Secretaria Municipal de Saúde de Tabatinga promoveu ação de saúde para comunitários presentes à oficina

Fiocruz Amazônia disponibiliza banco de currículo para alunos de Iniciação Científica
Ferramenta pretende auxiliar alunos que tenham interesse em trabalhar nos projetos da Instituição.

Fiocruz Amazônia inscreve para Curso de atualização em Tópicos de Saúde Coletiva até 31/5
No total, serão disponibilizadas 500 vagas para o curso que será ministrado entre os meses de julho e agosto de 2023.

Fiocruz inscreve para programas de iniciação científica e desenvolvimento tecnológico até 18/5
Os bolsistas são orientados por pesquisadores qualificados da Instituição, com oportunidade de acesso à técnicas e metodologias de pesquisa inovadoras.

Ressurgimento do sorotipo 3 do vírus da dengue preocupa especialistas
Estudo liderado pela Fiocruz sequenciou genoma dos vírus detectados em Roraima e no Paraná.

Fiocruz Amazônia prorroga inscrições para programa de iniciação científica
Interessados podem se inscrever até o dia 26/5.

Fiocruz Amazônia inscreve bolsistas para Programa de Iniciação Científica até 12/5
Programa visa despertar vocação científica e incentivar novos talentos potenciais entre estudantes de graduação.

Palestra do Centro de Estudos vai destacar abordagem metagenomica e suas aplicações na área clínica
Palestrante irá apresentar método de aplicação desta ferramenta na investigação ambiental por agentes de doenças fúngicas.

Doutorado em Saúde Pública na Amazônia prorroga inscrições até sexta-feira, 5/05
Inscrições foram prorrogadas até as 16h da sexta-feira, dia 5/05.

Resultado de projetos finalizados e novas pesquisas são apresentadas ao Comitê de Acompanhamento do Programa de Excelência em Pesquisa do ILMD FIOCRUZ AMAZÔNIA
O Programa visa à promoção da excelência na pesquisa, inovação e o desenvolvimento tecnológico em saúde nos Laboratórios de Pesquisa do Instituto

Médico concilia interesses do conhecimento tradicional indígena com a medicina ocidental na área rural de Tabatinga
As oficinas vêm ocorrendo em diferentes territórios, voltadas para ribeirinhos, quilombolas e de migrantes.

Projeto Manaós, da Fiocruz Amazônia, leva indígenas do Parque das Tribos para o Acampamento Terra Livre
O evento encerra nesta sexta-feira, com a leitura da carta final do ATL 2023.

Programa de Pós-Graduação em Biologia da Interação Patógeno Hospedeiro discute planejamento estratégico e autoavaliação em oficina na Fiocruz Amazônia
O evento abordou diferentes aspectos do processo de Avaliação da Pós-Graduação.

Seminário avaliará programa de excelência em pesquisa básica e aplicada em saúde dos laboratórios da Fiocruz Amazônia
Evento visa realizar prestação de contas do que foi realizado, bem como informar os resultados do novo edital.

Executivos da USAID visitam Fiocruz Amazônia e conhecem resultados do Projeto Amazônia: Ciência e Solidariedade
O projeto, iniciado em julho de 2022, é executado pela Fiocruz Amazônia e Fiotec, com apoio financeiro da USAID, em parceria com a NPI Expand e SITAWI Finanças para o Bem.

Fiocruz Amazônia cumpre agenda de visitas a parlamentares e organizações internacionais em Brasília para fortalecer apoio a projetos
A iniciativa teve como objetivo o fortalecimento das relações institucionais com autoridades do Legislativo e Executivo

Fiocruz Amazônia realiza oficina de autoavaliação e planejamento estratégico do PPGBIO-Interação
A participação dos discentes durante todo o evento poderá ser utilizada como Atividade Curricular-Complementar (ACC).

Estudo da Fiocruz mostra diferenças nos impactos da circulação das variantes do SARS-CoV-2 no Amazonas
Apesar de ter sido até três vezes mais transmissível do que a Gama e a Delta, variante Ômicron provocou menos casos graves e óbitos graças à vacinação.

Divulgada 1ª Republicação do processo de seleção de candidatos para ingresso no curso de doutorado em Saúde Pública
A republicação apresenta alterações nos itens que tratam dos recursos e avaliação do pré-projeto de pesquisa

Fiocruz Amazônia realiza mapeamento espacial da esporotricose animal e humana no Amazonas
O trabalho subsidiará também estudos acerca dos diferentes gêneros de fungos causadores da esporotricose, além de apoiar a elaboração de políticas públicas de enfrentamento da doença.

Centro de Estudos abordará estratégias biotecnológicas e triagem de moléculas da biodiversidade como alternativas no combate a doenças endêmicas
Palestra tentará mostrar um caminho possível para a região que permita prospectar qualitativamente novos fármacos oriundos da biodiversidade Amazônica

Fiocruz Amazônia promove I Workshop Estratégico de Pós-graduação
A ação ocorrerá ao longo de todo o primeiro semestre de 2023, para orientação dos estudantes ingressantes nos cursos de mestrado e doutorado do Instituto

Fiocruz Amazônia, UFAM e EUA abrem inscrições para curso de Doutorado em Saúde Pública
As inscrições ocorrem a partir de 28/4, e se encerram às 16h, do dia 3/5/2023.

Livro organizado por pesquisadores da Fiocruz Amazônia aborda práticas sociais de enfrentamento da pandemia no Amazonas
Obra documenta histórias e destaca esperanças nas falas dos usuários e trabalhadores da saúde, durante momento pandêmico, enfrentado por populações amazônicas.

Fiocruz Amazônia apresenta resultados parciais da pesquisa de vacina contra malária vívax no Japão
Pesquisadoras apresentaram os resultados parciais dos estudos pré-clínicos para o desenvolvimento de vacina contra a malária vivax

Fiocruz Amazônia realiza oficina de autoavaliação do PPGVIDA
O evento tem como finalidade discutir o cenário atual e as perspectivas futuras do programa, com a participação de docentes, discentes, egressos, gestores e representantes da coordenação.

Fiocruz Amazônia contribuiu com a metade dos genomas do vírus da COVID-19 sequenciados na Região Norte do País
Encontro apresentou as principais inovações na área de genômica com vistas ao enfretamento de desafios futuros.

Fiocruz Amazônia prestigia posse da nova diretoria do Cosems-AM
Presente à solenidade, a diretora do ILMD, Adele Schwartz Benzaken, destacou a relevância dessa parceria institucional

Fiocruz Amazônia e Semed são parceiros na execução de atividades do Espaço ECAM
O objetivo da palestra foi estimular as crianças e adolescentes a refletirem sobre a importância dos cuidados com a ingestão e o uso correto da água.

USAID, Fiocruz Amazônia e Fiotec elaboram guia orientador para oficinas de educação popular e comunicação em saúde no enfrentamento da COVID-19
O guia orientador é uma ferramenta educativa de gestão.

Projeto da Fiocruz Amazônia leva ribeirinhos a discutir e propor soluções para as demandas de saúde da comunidade
A reunião-piloto contou com a presença dos líderes comunitários e moradores, com o objetivo de mobilizá-los e fazê-los sentirem-se parte do projeto.

Centro de Estudos da Fiocruz Amazônia retoma ciclo de palestras
Palestrantes irão abordar o processo de produção de sínteses científicas para grandes problemas sistêmicos atuais: as Trajetórias bio-sócio-econômicas na Amazônia.

Fiocruz Amazônia participa de livro sobre riscos sanitários da atualidade
Em seu capítulo, o epidemiologista destaca os efeitos devastadores dos cerca de três anos de epidemia de Covid-19 e da negligência sanitária no Brasil.

Projeto da Fiocruz Amazônia investiga riscos de doenças cardiovasculares em indígenas desaldeados
O projeto irá desenvolver linhas específicas de ação, voltadas ao empoderamento comunitário, formação de agentes indígenas de saúde e a investigação de fatores de risco cardiovasculares dos indígenas que vivem na área urbana.

Projeto da Fiocruz Amazônia leva exposição ao Espaço Ecam do Manauara Shopping
Além da palestra sobre “A importância da água potável “, a pesquisadora levou ao espaço uma exposição interativa, com uso de microscópio e placas de bactérias patogênicas provenientes da água, que podem prejudicar a pessoa que as ingere.

Fiocruz Amazônia e USAID contam com apoiadores como pontos focais nas comunidades quilombolas, ribeirinhas e de migrantes
O treinamento dos apoiadores abordou os caminhos a serem percorridos pelos facilitadores em cada um dos territórios selecionados

Fiocruz Amazônia e USAID atuam na capacitação de mais de 500 agentes de saúde e de combate a endemias no enfrentamento à COVID 19 em Rondônia
Equipe de facilitadores responsáveis pelo treinamento esteve em sete municípios do Estado, com apoio da Fiocruz Rondônia, Conselho de Secretários Municipais de Saúde (Cosems-RO) e prefeituras

PPGBIO-INTERAÇÃO divulga lista de selecionados para vagas de alunos especial
Confira a lista de candidatos classificados

Pesquisa da ENSP/Fiocruz revela impacto da migração forçada sobre a saúde sexual e reprodutiva de refugiadas venezuelanas
Evento apresentará devolutiva de pesquisa sobre as condições do processo migratório e os impactos da migração sobre a saúde sexual e reprodutiva de mulheres e adolescentes venezuelanas.

Fiocruz Amazônia adere à campanha Dignidade Menstrual para arrecadação de absorventes
Um ponto de coleta foi montado na recepção da sede do ILMD/Fiocruz Amazônia com a finalidade de mobilizar e incentivar servidores, colaboradores e visitantes a fazerem doações.

‘Mulheres que Brilham na Ciência’ apresenta a entrevista com Adele Benzaken
Conheça o trabalho da médica e doutora em Saúde Pública, diretora do Instituto Leônidas & Maria Deane (ILMD Fiocruz Amazônia), primeira mulher a assumir a gestão da instituição em 27 anos.

Diretora da Fiocruz Amazônia profere palestra da Aula Magna do Programa de Pós-Graduação em Medicina Tropical e faz apanhado histórico da Sífilis
Falando para alunos e docentes do Programa de Pós-Graduação em Medicina Tropical, a médica fez um apanhado histórico da Sífilis, abordando registros do Período Medieval até a atualidade.

Aula inaugural da Fiocruz Amazônia abordará desafios de controle da malária na crise de saúde em Terra Indígena Yanomami
Palestras magna será ministrada pelo infectologista André Siqueira, que integra a missão do Ministério da Saúde na região Yanomami,

Fiocruz Amazônia divulga resultado preliminar do processo seletivo simplificado de bolsista de pós-doutorado
O prazo para interposição de recursos ocorre amanhã, dia 3/3.
Fiocruz Amazônia faz últimos ajustes para abertura do ano letivo institucional
Palestra inaugural ocorrerá no dia 13/3, às 9h.
Fiocruz Amazônia e Usaid lançam curso online e gratuito sobre agravos imunopreveníveis para agentes de saúde
A iniciativa é uma das estratégias do Projeto Amazônia, desenvolvido desde o ano passado pelo ILMD/Fiocruz Amazônia em parceria com a agência norte-americana Usaid por meio da New Partnerships Initiative (NPI Expand), a Sitawi Finanças do Bem, e com o financiamento da Usaid.

Fiocruz Amazônia lança projeto que visa formar agentes populares de saúde no interior do Amazonas
O projeto tem como objetivo ampliar a capacidade de resposta às doenças e agravos, a partir das experiências e da repercussão decorrente da pandemia da Covid-19

Divulgada 1ª Republicação do processo seletivo simplificado de bolsista de pós-doutorado
As Inscrições são gratuitas e ocorrem até hoje, 27/2

Fiocruz Amazônia recebe delegação de cientistas da Cardiff University
O encontro possibilitará a estruturação de futuras parcerias com a instituição.

Fiocruz Amazônia abre inscrições para processo seletivo simplificado de bolsista de pós-doutorado
As inscrições iniciam nesta sexta-feira, 17/2, e se estendem até o dia 27/2.

Fiocruz Amazônia e Ibama alinham atividades de investigação de patógenos em animais silvestres para 2023
o projeto investiga aspectos sanitários e epidemiológicos dos animais recebidos pelo Cetas.

PPGBIO-INTERAÇÃO prorroga prazo de inscrições para vagas de candidatos externos
As inscrições ocorrerão até o dia 22 de fevereiro de 2023

Professor da USP ministra aula do Doutorado em Saúde Pública da Fiocruz Amazônia
O pesquisador realiza estudos sobre fatores de risco, ferramentas de diagnóstico, prognóstico e tratamento de eventos de interesse em saúde pública,

PPGBIO-INTERAÇÃO oferece vagas para aluno especial
As inscrições ocorrerão até o dia 17 de fevereiro de 2023.

Fiocruz Amazônia e UEA propõem monitoramento epidemiológico do feminicídio na Região Norte
Projeto que visa explorar potencialidades da vigilância da informação em saúde à equidade de gênero, para caracterização epidemiológica e espaço-temporal dos assassinatos de mulheres, realizará oficina com diversos atores no início de março

Dia das Mulheres e Meninas na Ciência é marcado por homenagens da Fapeam a cientistas de destaque no Amazonas
A médica sanitarista Adele Schwartz Benzaken, primeira mulher a assumir a diretoria do Instituto Leônidas & Maria Deane (ILMD/Fiocruz Amazônia), em 27 anos de existência da instituição, foi uma das homenageadas no evento.

Fiocruz Amazônia recebe a visita do presidente em exercício da Fiocruz, Mario Moreira
Mário passou a ocupar a presidência da Fundação após a nomeação de Nísia Trindade Lima para assumir o Ministério da Saúde e permanecerá no cargo até o próximo processo eleitoral para a presidência, que será realizado em abril.

Fiocruz Amazônia convoca para matrícula institucional os aprovados para mestrado acadêmico do PPGVIDA
O período para matrícula ocorre entre os dias 13 e 15/02/2023

Fiocruz Amazônia convoca para matrícula institucional os aprovados no processo seletivo para ingresso no mestrado do PPGBIO-Interação
Aprovados devem observar atentamente os documentos necessários especificados na chamada pública

Fiocruz Amazônia convoca para matrícula institucional os aprovados no processo seletivo para ingresso no doutorado do PPGBIO-Interação
Aprovados devem se apresentar para efetivação da Matrícula Institucional.

Fiocruz Amazônia passa a contar com unidade móvel para ações de consultas e pesquisas viabilizada por emenda parlamentar
Objetivo de veículo é permitir a aproximação com a população, comunidades indígenas e ribeirinhas urbanas, com acesso terrestre, indo onde o povo está.

Fiocruz Amazônia reforça segurança de rede interna com instalação de novo nobreak
Iniciativa possibilitará maior segurança e funcionamento pleno da rede em casos de quedas bruscas do fornecimento de energia

Fiocruz Amazônia destaca investimentos em Ciência, Inovação e Tecnologia no aniversário de 20 anos da Fapeam
Na Fiocruz Amazônia, sete laboratórios de pesquisa possuem projetos financiados pela Fapeam.

Fiocruz Amazônia e USAID capacitam profissionais de laboratórios de fronteira em vigilância genômica nos estados de Roraima, Rondônia e Amazonas
A iniciativa visa ampliar a prestação de serviços na área de vigilância genômica da COVID-19, a partir do fortalecimento dos sistemas de prevenção, detecção e respostas às ameaças pandêmicas.

Fiocruz Amazônia realiza etapa de preparação de indígenas para o Mestrado em Saúde Coletiva em Tabatinga
A iniciativa faz parte do Programa de Ações Afirmativas do ILMD/Fiocruz Amazônia.

Conselho Deliberativo aprova curso de mestrado para indígenas e alterações no Regulamento do Ensino do ILMD/Fiocruz Amazônia
Conselheiros aprovaram proposta de criação da primeira turma fora da sede do PPGVIDA, destinada única e exclusivamente a indígenas da região de fronteira do Alto Solimões.
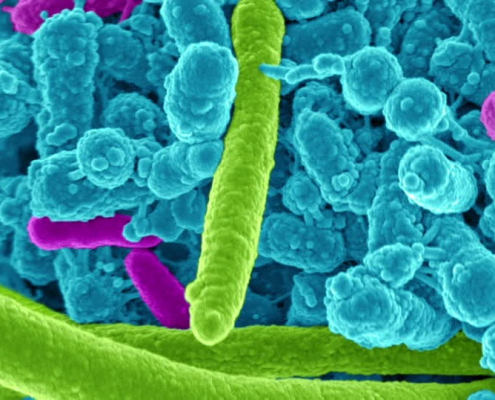
Prorrogado prazo para submissão de trabalhos ao 8º Congresso sobre Diversidade Microbiana da Amazônia até 15/02
Confira a programação e garanta sua inscrição.

Doutorado em Saúde Pública na Amazônia do ILMD/Fiocruz Amazônia tem sua primeira defesa de tese aprovada
A pesquisa contou com fomento da Fundação de Amparo à Pesquisa do Estado do Amazonas (FAPEAM)
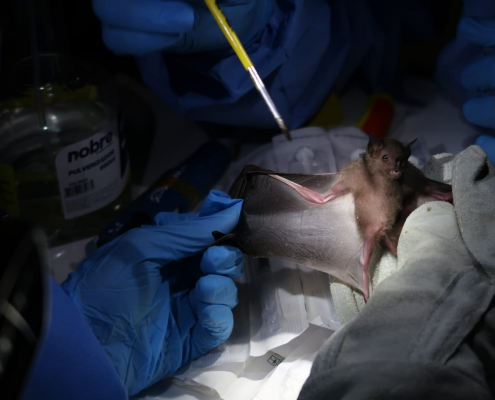
Fiocruz Amazônia integra rede para investigação de mordeduras tropicais
O próximo encontro da rede deverá acontecer em 2024, na sede da Fiocruz Amazônia, em Manaus.

Fiocruz oferece primeiro Mestrado em Epidemiologia aplicada à Saúde da Mulher e da Criança na Amazônia
Curso destina-se a técnicos e profissionais de saúde de nível superior que atuem nos estados do Amazonas, Roraima e Rondônia. Futuramente, será ampliado para os demais Estados da Região Norte

Nota de Repúdio do Conselho Deliberativo da Fiocruz aos Atos Antidemocráticos
A instituição apoia as medidas de Estado para o restabelecimento imediato da ordem
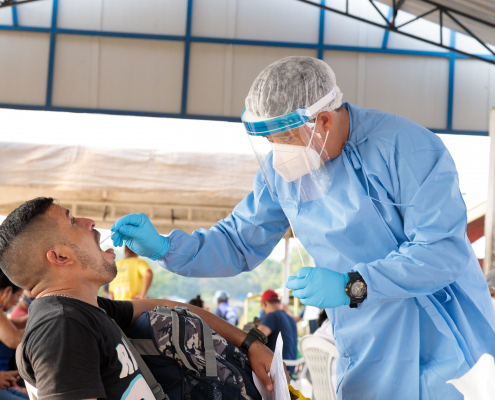
Fiocruz Amazônia homenageia a todos os sanitaristas do Brasil neste dia 2/01
A data é emblemática e representa uma associação temporal direta e marcante entre ações de sanitaristas e políticas de saúde no Brasil.

Fiocruz Amazônia atinge 10 mil genomas depositados do SARS-CoV-2
O trabalho de vigilância genômica do SARS-CoV-2 é realizado desde o início da pandemia.

Divulgado resultado final do Processo Seletivo para ingresso no curso de doutorado do PPGBIO-Interação
Confira o resultado final do Processo Seletivo

Fiocruz Amazônia divulga resultado definitivo da 4ª Etapa e classificação final do processo seletivo para ingresso no curso de mestrado do PPGBIO-Interação
Confira a classificação final do processo seletivo

Divulgada pontuação dos currículos e, a lista dos classificados no processo seletivo do Doutorado Acadêmico do PPGBIO-Interação
Confira a lista dos classificados no processo seletivo

Fiocruz Amazônia apresenta resultados do projeto de fortalecimento da resposta à COVID-19 em territórios indígenas na Amazônia brasileira
Projeto teve nove meses de duração e o foco voltado para as áreas de vigilância de base comunitária, nutrição, bem viver/saúde mental e medicina indígena.

Fiocruz Amazônia divulga 3ª, 4ª etapa e classificação final do processo seletivo para ingresso no curso de mestrado do PPGBIO-Interação
Confira a classificação final do processo seletivo.

Programa de Doutorado em Saúde Pública na Amazônia discute planejamento estratégico e autoavaliação em seminário
O tema pautou, inclusive, o debate no II Encontro dos Programas de Pós-Graduação em Saúde Coletiva no Amazonas sobre estratégias para a qualificação da pós-graduação,

Rede Unida e Fiocruz Amazônia comemoram dez anos do Laboratório de História, Políticas Públicas e Saúde na Amazônia em 6º Encontro Regional Norte
Encontro terá como tema central “Redes de produção de saúde na Amazônia e parcerias nacionais e internacionais: territórios vivos que transbordam fronteiras”.

LAHPSA e Rede Unida selecionam manuscritos para compor livro sobre gestão em saúde na Amazônia
Os autores interessados poderão inscrever seus manuscritos até o próximo dia 24/12
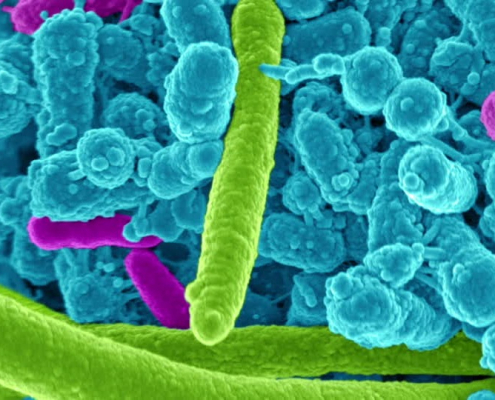
Fiocruz Amazônia é parceira do 8º Congresso sobre Diversidade Microbiana da Amazônia
O Congresso terá como tema “Desafios e Oportunidades”

Fiocruz Amazônia divulga resultado preliminar da prova oral para ingresso do curso de doutorado do PPGBIO-Interação
Confira o resultado preliminar da 2ªetapa (Prova Oral) da Chamada Pública 023/2022

Divulgado resultado preliminar da prova oral do Mestrado Acadêmico do PPGBIO-Interação
Confira o resultado preliminar da 3ª etapa (prova oral) do processo seletivo.

Parceria USAID, NPI EXPAND, SITAWI e Fiocruz Amazônia realiza treinamento de tutores para curso de atualização em agravos imunopreveníveis de interesse em saúde pública na Amazônia, ofertados para municípios do Amazonas e Rondônia, através de plataforma AVA
O referido curso, assim como o ofertado de forma presencial para 21 municípios previamente selecionados

Correspondente da Science Magazine conhece projetos da Fiocruz Amazônia
O correspondente foi acompanhado por pesquisadores do ILMD/Fiocruz Amazônia nas visitas de campo e considerou a prática bastante produtiva.

Fiocruz Amazônia trabalha na finalização da planta arquitetônica da nova sede da instituição em Manaus
A proposta apresentada é a de um prédio com cinco andares e capacidade para concentrar todos os laboratórios de pesquisa da Fiocruz Amazônia, ocupando uma área de 14.512,80 metros quadrados.

Cônsul-geral do Japão em Manaus visita Fiocruz Amazônia para debater cooperação
A comitiva foi recebida pela diretora da Fiocruz Amazônia, Adele Schwartz Benzaken, e a vice-diretora de Pesquisa e Inovação, Stefanie Lopes.
 https://amazonia.fiocruz.br/wp-content/uploads/2022/12/Chamada-Pub_022-22-2a-Etapa-Public-Resultado-Final-da-Prova-Escrita_TopoMateria-1.jpg
354
828
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2022-12-06 16:51:282022-12-06 16:51:29Divulgado resultado da prova final da escrita do processo seletivo para mestrado PPGBIO-Interação
https://amazonia.fiocruz.br/wp-content/uploads/2022/12/Chamada-Pub_022-22-2a-Etapa-Public-Resultado-Final-da-Prova-Escrita_TopoMateria-1.jpg
354
828
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2022-12-06 16:51:282022-12-06 16:51:29Divulgado resultado da prova final da escrita do processo seletivo para mestrado PPGBIO-Interação
Fiocruz Amazônia divulga inscrições homologadas para processo de seleção do curso de doutorado do PPGBIO-Interação
Confira as inscrições Homologadas da Chamadas Públicas 023/2022

Divulgado resultado da prova escrita do processo seletivo para mestrado PPGBIO-Interação
O processo de seleção ocorre em quatro 4 etapas.

Fiocruz Amazônia promove capacitação sobre geoprocessamento e análise espacial em saúde
Participantes tiveram a oportunidade de manipular softwares de geoprocessamento e equipamentos necessários para aquisição e georreferenciamento de dados espaciais.

Fiocruz Amazônia divulga nova republicação para processo de seleção do curso de doutorado do PPGBIO-Interação
Republicação apresenta alteração no cronograma do processo de seleção e, instruções para pagar GRU.

Divulgada análise dos recursos e resultado final da homologação das inscrições para mestrado PPGBIO-Interação
Confira o resultado das inscrições homologadas da Chamada Pública 022/2022

Palestra do Centro de Estudos irá abordar diferentes aspectos da situação atual de algumas arboviroses no Brasil
O Centro de Estudos do ILMD/Fiocruz Amazônia é um núcleo que oportuniza encontros, palestras, seminários e debates sobre diversos temas ligados à pesquisa e ao ensino

Diretora da Fiocruz Amazônia aborda Prevenção Combinada durante a II Oficina de Novas Lideranças Jovens HIV+ e LGBTQIA+ em Manaus
A médica sanitarista atuou como facilitadora na oficina sobre Prevenção Combinada, com a aplicação da dinâmica da Mandala da Prevenção para os participantes.

Fiocruz Amazônia recebe lançamento do livro Vidas Que Falam 2
A obra reúne quase 40 autores, que aceitaram o convite e o desafio de relatar em forma de textos o testemunho e a história de personalidades.

Fiocruz Amazônia marca presença no 13º Congresso de Saúde Coletiva da Abrasco 2022
O Abrascão 2022 promoverá debates transversais e livres, com a parceria de instituições governamentais e não-governamentais

Palestra do Centro de Estudos irá abordar aspectos evolutivos, biológicos e comportamentais que influenciam no surgimento das pandemias
Atividade é destinada a estudantes de graduação e pós-graduação, pesquisadores, professores e trabalhadores da área da Saúde.

Fiocruz Amazônia discute Planejamento Estratégico dos cursos de Mestrado e Doutorado do PPGBIO
A reunião propôs o aperfeiçoamento de estratégias que visem divulgar o acervo acadêmico virtual da instituição

Aluna egressa do Mestrado do PPGBIO, da Fiocruz Amazônia, recebe Prêmio Jovem Pesquisador do MEDTROP 2022
O prêmio tem como objetivo estimular e promover o reconhecimento dos trabalhos de jovens pesquisadores na área de medicina tropical

Fiocruz Amazônia integra pesquisa e coordenação de seminário sobre acesso à saúde e vulnerabilidades de migrantes internacionais
Pesquisa visa identificar as problemáticas relacionadas ao acesso à saúde e proteção social dos migrantes internacionais e refugiados
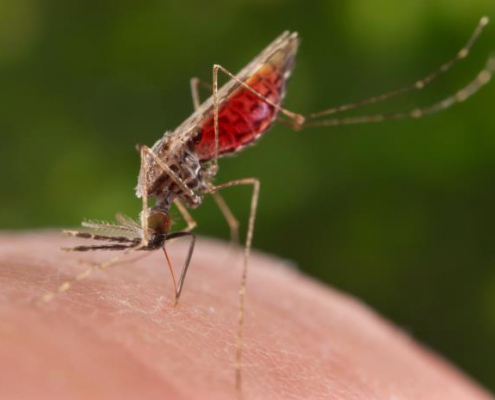
Pesquisadores da Fiocruz Amazônia palestram em Simpósio de Doenças Tropicais da Faculdade Estácio Amazonas
Evento promoverá discussões acerca das principais doenças tropicais que ocorrem na Amazônia

Fiocruz Amazônia prorroga prazo de inscrições ao Mestrado do PPGBIO-Interação
O início das aulas está previsto para ocorrer no dia 13/3/2023.

Projeto USAID/NPI Expand conta com apoio dos secretários municipais de Saúde do Amazonas, Rondônia, Acre e Roraima
Pactuação prevê compromisso das secretárias municipais em apoiar o desenvolvimento de estratégias de saúde do projeto.

Palestra do Centro de Estudos da Fiocruz Amazônia irá abordar Capacidade vetorial de flebotomíneos
Pesquisador apresentará conceitos do modelo e aplicações na vigilância entomológica no Brasil.

Fiocruz Amazônia prorroga inscrições e altera calendário do processo seletivo para mestrado em Condições de Vida e Situações de Saúde na Amazônia
Republicação destaca prorrogação do período de inscrição e, alteração das demais etapas do processo seletivo

Virologista da Fiocruz Amazônia destaca que aumento de casos de COVID-19 no Amazonas está associado à circulação da subvariante BA.5.3.1
A subvariante BQ.1 foi encontrada em apenas um caso no Amazonas até o momento.

Fiocruz Amazônia divulga republicação de chamadas públicas para ingresso nos cursos de mestrado e doutorado em Biologia da Interação Patógeno Hospedeiro
Republicação apresenta alterações em ambos os processos seletivos

Fiocruz mobiliza unidades do Norte e Nordeste para criação Rede de Vigilância em Patógenos Circulantes na Fauna Silvestre em parceria com o Plataforma Internacional
O objetivo é estabelecer as bases para a sistematização das atividades da Fiocruz no escopo da Saúde Única

OPAS visita Fiocruz Amazônia para definição de agendas futuras de cooperação
Visita ao ILMD/Fiocruz Amazônia fez parte da agenda de visitas a instituições parceiras no Amazonas

Fiocruz Amazônia prorroga prazo para inscrições ao processo seletivo para Mestrado Acadêmico em Condições de Vida e Situações de Saúde na Amazônia
O início das atividades acadêmicas está previsto para o dia 13/3/2023.

Orientanda do ILMD Fiocruz Amazônia tem trabalho eleito como melhor tese de doutorado do PPGIBA da Ufam
Entrega do prêmio será entregue na segunda-feira, 7/11, em solenidade no Auditório Rio Amazonas, da Faculdade de Estudos Sociais (FES).

Impacto da pandemia de Covid-19 sobre a mortalidade materna no Brasil será tema de palestra do Centro de Estudos da Fiocruz Amazônia
Estudo mostrou forte excesso de mortes maternas no Brasil

USAID e Fiocruz Amazônia fortalecem enfrentamento da Covid-19 no Amazonas, Roraima, Acre e Rondônia
O trabalho será desenvolvido junto às populações ribeirinhas, indígenas, imigrantes e quilombolas nos estados do Amazonas, Acre, Roraima e Rondônia.

Fiocruz Amazônia avalia impactos da pandemia sobre a violência no primeiro seminário do Programa de Articulação Intersetorial Violência e Saúde da Fiocruz
O Seminário tratou, entre outros temas, das relações entre a ocorrência de homicídios e suicídios e o dramático desenvolvimento da epidemia de COVID-19 na região

Fiocruz Amazônia, Unicef e organizações indígenas reúnem lideranças e pajés em Manaus para workshop Medicina Indígena
O workshop cumpre mais uma etapa da formação do Projeto ECHO COVID, de Fortalecimento da Resposta ao Covid-19 na Região Amazônica do Brasil.

Seminário realizado pela Fiocruz Amazônia discute estratégias de vigilância em saúde indígena
A ação é uma oportunidade de unir as ações e mensurar resultados dos projetos desenvolvidos pela Fiocruz Amazônia em prol das populações indígenas

Fiocruz Amazônia leva universo da ciência para mais de 1,2 mil crianças e jovens da rede estadual de ensino
Evento contou com exposições, apresentação de teatro, vídeos, oficina de podcast para divulgação científica, jogos, rodas de conversa.

Fiocruz Amazônia divulga podcasts de divulgação científica produzidos durante a SNCT 2022
A oficina foi realizada como parte da programação da Semana Nacional da Ciência e Tecnologia (SNCT-2022) da Fiocruz Amazônia.

Fiocruz Amazônia lança chamada pública para mestrado acadêmico em Condições de Vida e Situações de Saúde na Amazônia
As inscrições ocorrem entre os dias 25/10 e 7/11.

Centro de Estudos da Fiocruz Amazônia irá abordar estruturas multiproteicas e suas aplicações nas áreas de vacina, diagnóstico e terapia
A palestra tem como objetivo abordar os principais tipos de VLPs, suas propriedades e aplicações na área de biotecnologia.

Fiocruz lança chamada para Pesquisador Visitante Sênior
A chamada é voltada a professores/pesquisadores de elevada qualificação acadêmica, preferencialmente internos à Fiocruz, em atividade ou aposentados.

Pesquisadora da Fiocruz Amazônia recebe menção honrosa do Prêmio Oswaldo Cruz de Teses 2022
A premiação está na sexta edição e tem como objetivo prestar uma homenagem a alunos e docentes, que contribuem para o avanço na produção de conhecimento em saúde no Brasil

Fiocruz Amazônia reúne representantes de projetos voltados para a saúde indígena nas cidades
Objetivo é avaliar o impacto das intervenções realizadas a partir do Programa Fiocruz de Fomento à Inovação, o Inova Fiocruz

Fiocruz Amazônia abre processo seletivo para curso de doutorado acadêmico em Biologia da Interação Patógeno Hospedeiro
As inscrições ocorrem até o dia 25/11.

Fiocruz Amazônia abre inscrições para mestrado acadêmico em Biologia da Interação Patógeno Hospedeiro
Até o dia 17/10, ocorre o período para solicitação da isenção da taxa de inscrição.

Estudo científico sobre envenenamentos ofídicos será apresentado no Centro de Estudos da Fiocruz Amazônia
Pesquisador abordará estudos com olhar especial para acidentes ofídicos na Amazônia brasileira

Fiocruz Amazônia leva ciência, tecnologia e arte para escolas públicas durante a SNCT 2022
A programação visa levar atividades desenvolvidas pela Fiocruz Amazônia, por meio de exposições, rodas de conversa e apresentações artísticas, a escolas da rede pública de Manaus.

Fiocruz Amazônia realiza seminário sobre Violência e Saúde em Tempos de Emergências Sanitárias Globais
O evento acontecerá no formato híbrido, com limite presencial de até 50 pessoas no Salão Canoas, na sede do ILMD/Fiocruz Amazônia

Fiocruz Amazônia abre inscrições para oficina de divulgação científica por meio de podcasts
A capacitação marca o início das atividades Institucionais na Semana Nacional de Ciência e Tecnologia (SNCT)

Boas práticas de redação científica serão abordadas durante palestra do Centro de Estudos da Fiocruz Amazônia
As atividades são destinadas a estudantes de graduação e pós-graduação, pesquisadores, professores e trabalhadores da área da Saúde.

Palestra do Centro de Estudos abordará desafio “One Health” para um Brasil Pós-Pandemia
As atividades são destinadas a estudantes de graduação e pós-graduação, pesquisadores, professores e trabalhadores da área da Saúde.

Fiocruz Amazônia e UNICEF realizam oficina de medicina indígena no Alto Rio Solimões
Oficinas têm como objetivo compartilhar conhecimentos e construir redes de saberes tradicionais.

Fiocruz Amazônia leva estratégia de controle vetorial de Aedes aegytpi para a Colômbia
As estações disseminadoras já foram testadas e aprovadas em 14 cidades brasileiras. Na Colômbia, Santa Marta será a segunda a receber.

Reforma e adequações de espaço potencializam ações de ensino na Fiocruz Amazônia
Na gestão do Ensino, várias mudanças ocorreram no intuito de oferecer melhores condições de trabalho aos colaboradores e atendimento aos alunos e professores.

Fiocruz Amazônia realiza acolhida aos primeiros bolsistas do Provoc no Amazonas
Durante a acolhida, os estudantes foram apresentados aos orientadores e co-orientadores que os acompanharão ao longo de 12 meses, correspondentes à primeira etapa do programa, que é a da Iniciação.

Palestra do Centro de Estudos irá abordar pesquisa sobre Tripanosomatídeos em mamíferos
Pesquisador abordará diferentes gêneros, espécies, genótipos de tripanosomatídeos que vem sendo encontrados infectando mamíferos.

Programas de pós-graduação stricto sensu do ILMD/Fiocruz Amazônia passam pela primeira avaliação quadrienal da Capes
Vice-diretoria de Ensino, Informação e Comunicação do ILMD/Fiocruz Amazônia, avalia como positivos os resultados.

Estudo inédito avalia impacto da pandemia de Covid-19 sobre a mortalidade materna no Brasil
Pesquisa realizada por grupo de epidemiologistas, coordenado pela Fiocruz Amazônia, apontou aumento significativo de mortes maternas no País

Fiocruz Amazônia defende linhas de pesquisa em saúde, capacitação o combate à violência contra minorias étnicas como diferenciais de resistência nos 68 anos da Ensp
Amazônia Legal possui a menor taxa de mestres e doutores do País

Palestra do Centro de Estudos irá abordar propriedades imunomoduladoras e impacto no desenvolvimento da Leishmaniose Tegumentar
As atividades são destinadas a estudantes de graduação e pós-graduação, pesquisadores, professores e trabalhadores da área da Saúde.

Fiocruz Amazônia avalia trabalhos inscritos para a etapa regional Norte da 11ª Olimpíada Brasileira de Saúde e Meio Ambiente
A comissão de avaliação da Etapa Regional Norte foi formada por profissionais e pesquisadores das áreas temáticas variadas.

Centro de Estudos abordará Emergências Sanitárias e Saúde Global
Palestrante apresentará estudos produzidos no contexto das ciências sociais sobre as emergências sanitárias

Fiocruz Amazônia forma segunda turma de agentes multiplicadores em prevenção de IST/HIV/Aids em curso oferecido à profissionais da saúde da Marinha do Brasil
Ação visa o aprimoramento no acesso e atuação das equipes da Marinha do Brasil

Guia das Parteiras Tradicionais é validado na primeira reunião da nova diretoria da Associação Algodão Roxo
O guia é um material adaptado à realidade amazônica e poderá ser utilizado pelas próprias parteiras e profissionais da rede de saúde.

Estratégias de qualificação e novas metodologias sobre saúde pública na Amazônia são temas de evento gratuito
Nos quatro dias de eventos acontecerão palestras, rodas de conversas, mesas de debate, atividades culturais e apresentações de trabalhos científicos.

Fiocruz Amazônia realiza evento de acolhida para novos alunos do Programa de Iniciação Científica
Palestra de abertura abordará Divulgação Científica nas redes sociais

Fiocruz Amazônia promove palestra sobre práticas e experiências do Núcleo de Inovação Tecnológica
A atividade é voltada exclusivamente para os alunos do programa

Comemoração dos 28 Anos do ILMD/Fiocruz Amazônia e primeiro ano de gestão da atual diretoria
Servidores, colaboradores terceirizados, bolsistas, alunos, vice-diretores e diretoria estiveram juntos e representados durante dois dias de atividades programadas para marcar o aniversário da Unidade.

Centro de Estudos abordará diversidade de maruins na Amazônia brasileira e uso da Taxonomia integrada
Na oportunidade, serão apresentados estudos de taxonomia integrada, que agregam caracteres morfológicos, morfométricos e genéticos, em diversas famílias de dípteros, inclusive vetores.

Prorrogado prazo para inscrever trabalhos científicos sobre saúde pública na Amazônia no IV Encontro da Pós-Graduação do ILMD/Fiocruz Amazônia
Programação terá mesas de debates, palestras, rodas de conversa, apresentação de pesquisas científicas e atividades culturais.

Centro de Estudos abordará pesquisas que envolvem patógeno associado a doenças neonatais
As atividades são destinadas a estudantes de graduação e pós-graduação, pesquisadores, professores e trabalhadores da área da Saúde.

Fiocruz Amazônia e Ibama atuam juntos em projeto que alia conservação da fauna silvestre e investigação de patógenos causadores de doenças
O estudo possui finalidade de aliar o trabalho de conservação da fauna silvestre com a investigação de patógenos causadores de doenças de origem animal.

Fiocruz Amazônia faz primeiros sequenciamentos de genoma do vírus causador da Monkeypox na região norte
O Núcleo de Vigilância do EDTA é um dos quatro laboratórios referência nacional entre os oito credenciados pelo Ministério da Saúde para o diagnóstico de casos da monkeypox no Brasil.

Seminário Científico marcará comemoração de aniversário dos 28 anos da Fiocruz Amazônia
Programa estratégico para consolidação da pesquisa, desenvolvimento e inovação em saúde pública na Amazônia será lançado durante o evento

Centro de Estudos irá abordar plataforma de bioensaios para o estudo pré-clínico de substâncias e formulações vacinais com potencial antimalárico
As atividades são destinadas a estudantes de graduação e pós-graduação, pesquisadores, professores e trabalhadores da área da Saúde.

Consulta sobre política de equidade de gênero é lançada na reunião do CD do ILMD/Fiocruz Amazônia
Evento acontece bimestralmente e reúne representantes de todos os setores do ILMD.

Fiocruz Amazônia é referência para diagnóstico laboratorial da monkeypox na Região Norte
O ILMD passou a integrar a rede nacional de referência para esses casos, capazes de responder com o diagnóstico, referendado pelo Ministério da Saúde.

Biblioteca do ILMD/Fiocruz Amazônia completa 20 anos de criação no Dia Nacional da Saúde, 5/8
Comunidade ILMD/Fiocruz Amazônia volta a realizar consultas presenciais ao acervo, a partir deste mês de agosto.

Centro de Estudos vai abordar Aspectos bioecológicos de mosquitos vetores em área de influência de empreendimento hidrelétrico na Amazônia brasileira
Apresentação abordará estudos que investigaram aspectos bioecológicos da comunidade de mosquitos presente na área de abrangência da hidrelétrica Jirau, em Porto Velho (RO).
 https://amazonia.fiocruz.br/wp-content/uploads/2022/08/94e9ca51-9397-46f6-bc37-de2f9ef25dfe-1.jpg
1066
1600
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2022-08-01 15:20:342022-08-01 15:20:36Vice-diretoria de Ensino do ILMD/Fiocruz Amazônia realiza Reunião de Integração para alinhamento de atividades
https://amazonia.fiocruz.br/wp-content/uploads/2022/08/94e9ca51-9397-46f6-bc37-de2f9ef25dfe-1.jpg
1066
1600
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2022-08-01 15:20:342022-08-01 15:20:36Vice-diretoria de Ensino do ILMD/Fiocruz Amazônia realiza Reunião de Integração para alinhamento de atividades
Fiocruz Amazônia e Ufam convocam participantes do projeto DETECTCoV-19
Na próxima segunda-feira, 1/8, a equipe do projeto passará a atender em novo endereço

Centro de Estudos irá abordar descarte de medicamentos domiciliares e a importância da logística reversa
As atividades são destinadas a estudantes de graduação e pós-graduação, pesquisadores, professores e trabalhadores da área da Saúde

Fiocruz abre inscrições para o IV Encontro de Pós Graduação com tema voltado para o papel da pós-graduação frente aos desafios em saúde pública na Amazônia
Evento on-line, gratuito e poderão participar pesquisadores, alunos de pós-graduação e iniciação científica e profissionais da saúde e de áreas afins, de todo o país, que queiram discutir temáticas acerca da saúde pública na Amazônia

Fiocruz Amazônia promove oficina de Comunicação Científica para discentes dos programas de pós-graduação
A atividade terá como público-alvo os pesquisadores e alunos dos cursos de pós-graduação da Instituição.

Fiocruz Amazônia recebe alunos que concorrem ao Programa de Vocação Científica
objetivo do Programa é estimular a aprendizagem e o conhecimento científico a partir da experimentação de práticas de pesquisa.

Centro de Estudos irá abordar desmatamento, doenças infecciosas e saúde pública
A atividade é destinada a estudantes de graduação e pós-graduação, pesquisadores, professores e trabalhadores da área da Saúde.

Vacina BCG: lições a partir da análise genômica funcional será tema do Centro de Estudos
Pesquisador abordará os estudos sobre o Mycobacterium bovis BCG Moreau, a partir da análise genômica da cepa utilizada no Brasil para a produção da vacina contra a tuberculose

ILMD/Fiocruz Amazônia e Cogepe discutem Programa de Gestão e Desempenho no II Fórum Regional de Gestão de Pessoas
Evento visa promover discussão acerca de temas de interesse dos servidores, colaboradores e discentes, cumprindo programação de visitas às unidades descentralizadas da Fiocruz no Brasil.
Edital Inovação Amazônia contempla 20 projetos com financiamento para pesquisas científicas nos Estados do AM e RO
Reunião de integração dos contemplados permitiu o conhecimento e o intercâmbio de informações sobre os objetivos de cada trabalho

Jovens comunicadores indígenas recebem formação em medicina tradicional
O evento acontece de forma virtual, por meio da Fiocruz Amazônia, e visa a formação de práticas da medicina tradicional a jovens comunicadores indígenas

Reunião na Fiocruz Amazônia pauta Planejamento Estratégico para Mestrado Profissional em Saúde da Família
Reunião visa reafirmar compromissos do Programa, além de estabelecer novas metas e estratégicas para o quadriênio 2022 e 2025.
Estudo reafirma importância da vacina contra Covid-19 para crianças e adolescentes ao avaliar trajetória de mortes pela doença em distintos grupos etários entre 2021 e 2022
Pesquisador salienta que o impacto da mortalidade por Covid-19 em crianças segue aumentando no Brasil, sobretudo nas que ainda não foram vacinadas.

Escritório de Projetos da Fiocruz Amazônia recebe devolutiva de projeto que visa fortalecer estratégia de atuação em rede no País
O objetivo da visita é fazer uma devolutiva da pesquisa, realizada ao longo dos últimos dois anos, junto a 13 escritórios de projetos, pertencentes às unidades técnico-científicas da Fiocruz no Brasil.

Centro de Estudos da Fiocruz Amazônia abordará complexo de espécies em artrópodes vetores
Pesquisador apresentará estudos recentes com o complexo L. longipalpis e, também, outros grupos de artrópodes

Curso on-line da Fiocruz e do UNFPA sobre emergências obstétricas certifica 320 profissionais de saúde na Região Norte
Na próxima segunda-feira, 4, será realizado o encerramento virtual com a presença de representantes das organizações e de profissionais que participaram do curso
 https://amazonia.fiocruz.br/wp-content/uploads/2022/06/c27f02b0-3160-42ef-87bf-01f11a15f45b.jpg
354
828
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2022-06-28 14:18:382022-06-28 14:18:38Pesquisa é um dos setores vulnerabilizados pela falta de segurança em áreas indígenas no Amazonas
https://amazonia.fiocruz.br/wp-content/uploads/2022/06/c27f02b0-3160-42ef-87bf-01f11a15f45b.jpg
354
828
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2022-06-28 14:18:382022-06-28 14:18:38Pesquisa é um dos setores vulnerabilizados pela falta de segurança em áreas indígenas no Amazonas
Pesquisadores da Fiocruz apresentam impacto de pesquisas em saúde desenvolvidas no Amazonas
O evento teve dois dias de duração e se encerrou nesta quinta-feira, 23/06, reunindo cientistas de 21 instituições contempladas em editais de pesquisa da Fapeam.

Fiocruz Amazônia propõe parceria com UEA para ampliar oferta de cursos de pós-graduação no interior e projetos de pesquisas em saúde no Amazonas
Parceria visa o uso do ambiente próprio para o ensino presencial, mediado por tecnologia da UEA para as ações da Fiocruz no âmbito do Programa VigiFronteiras - Brasil

Colegiado discute novo Planejamento Estratégico do PPGVIDA
Novo Planejamento Estratégico do PPGVIDA busca pensar na sua missão, valores e diretrizes para o período

Centro de Estudos vai abordar pesquisa aplicada ao monitoramento da qualidade de vida de pessoas vivendo com HIV/Aids no Amazonas
As atividades são destinadas a estudantes de graduação e pós-graduação, pesquisadores, professores e trabalhadores da área da Saúde.

Fiocruz Amazônia apresenta resultados de estudo sobre saúde da população indígena em contexto urbano
Ação foi marcada pela entrega do relatório final das atividades do projeto, que avaliou as condições de saúde da população indígena, residente na Comunidade.

Programa de Iniciação Científica da Fiocruz Amazônia divulga resultado preliminar do processo de seleção
O início das atividades está previsto para o dia 1º. de agosto deste ano.

Pesquisadora da Fiocruz Amazônia é selecionada para participar do The Future Of One Health
Alessandra Nava, da Fiocruz Amazônia, foi uma das 40 especialistas selecionadas a integrar o movimento

Bruno Pereira e Dom Phillips: um crime contra os povos indígenas e a liberdade de imprensa
Presidência da Fiocruz lamenta profundamente o ocorrido e presta sentimentos às famílias de Bruno Pereira e Dom Phillips

Centro de Estudos vai abordar pesquisa sobre parto e nascimento no Brasil
Palestra irá apresentar resultados e alcance da pesquisa "Nascer no Brasil".

Dossiê Mulheres e Meninas na Ciência é lançado no ILMD/Fiocruz Amazônia
Livro reúne um conjunto de experiências de mulheres cientistas da Fiocruz no Brasil.

Escolas da rede estadual recebem equipe da Fiocruz Amazônia e da Obsma
Este ano, o Prêmio Menina Hoje Cientista Amanhã vai homenagear a cientista paraense Maria Deane.

Pesquisador da Fiocruz publica estudo apontando relação entre violência urbana e transtornos mentais
Estudo proveniente da coorte de nascimentos de 1982 da cidade de Pelotas, cuja população foi acompanhada ao longo de 30 anos, serviu de base para artigo científico publicado na revista "Frontiers in Public Health”

Ex-ministro português visita sede do ILMD/Fiocruz Amazônia
A reunião abordou o desenvolvimento de projetos de Ciência, Tecnologia e Inovação, realizados em parceria com a Fiocruz, com especial atenção para temáticas ligadas às mudanças climáticas, seus aspectos antrópicos e o impacto sobre a saúde das populações.

Diretora da Fiocruz Amazônia aborda epidemia de HIV/Aids no Brasil em entrevista ao Hora H
Milésimo programa apresentado pelo jornalista Humberto Amorim destacou avanços e retrocessos no diagnóstico e tratamento da infecção

Programa de Iniciação Científica da Fiocruz Amazônia divulga alteração no cronograma do processo de seleção
O resultado será divulgado no dia 20 de junho de 2022

Equipe olímpica da Fiocruz realiza Oficina Alunos em Ação em escolas da rede pública de Manaus (AM)
A atividade irá homenagear a cientista paraense Maria Deane.

Centro de Estudos vai abordar aprendizados com infortúnios da pandemia de COVID-19
Palestra pretende revisitar a gestão da pandemia no Brasil.

Conselho Deliberativo da Fiocruz Amazônia realiza primeira reunião presencial do ano
O Conselho Deliberativo é um órgão colegiado que reúne representantes dos vários setores do ILMD.

Fiocruz/ Obsma e Seduc promovem evento de abertura do calendário da Semana do Meio Ambiente
Atividade faz parte do ciclo de ações de divulgação da 11ª Obsma, nas escolas da rede estadual durante o mês de junho

19ª RAIC da Fiocruz Amazônia encerra com premiação de projetos
Seis projetos destacaram-se durante a 19ª Raic, sendo um em cada categoria.

19ª RAIC: Estudantes apresentam projetos nas áreas de parasitologia, imunologia, entomologia, biotecnologia e bioprospecção
Programação terá encerramento na tarde de hoje, 2/6, com a premiação dos projetos destaques desta edição.

19ª RAIC: Graduandos apresentam projetos nas áreas de Microbiologia, Saúde Coletiva e COVID-19
Apresentações encerram nesta sexta, 2/2, com premiação dos projetos destaques em cada uma das sessões.

Palestra do Centro de Estudos vai abordar território e políticas públicas de saúde na Amazônia
Palestra é destinada a estudantes de graduação e pós-graduação, pesquisadores, professores e trabalhadores da área da Saúde.

Pesquisas em malária da Fiocruz Amazônia são tema de podcast As Amazonas
O tema da entrevista girou em torno da malária e das pesquisas em favor da produção mundial de vacinas contra a doença.

Disrupção e transformação tecnológica acelerada são abordadas durante abertura da 19ª RAIC da Fiocruz Amazônia
O evento ocorre até quinta-feira, 2/6, com apresentação dos resultados de projetos do PIC, em diferentes áreas do conhecimento.

Fiocruz capacita agentes de endemias de Santa Catarina na instalação do instrumento armadilhas contra o mosquito Aedes aegypti, transmissor da dengue
O plano de capacitação para o controle do Aedes foi apresentado nesta segunda-feira, no auditório do Laboratório Central (Lacen), de Florianópolis

Fiocruz e Seduc realizam evento de divulgação da 11ª Olimpíada Brasileira de Saúde e Meio Ambiente nas escolas da rede estadual
Este ano, o Prêmio Menina Hoje Cientista Amanhã, em homenagem à cientista Maria Deane, vai selecionar trabalho ou projeto inscrito na Olimpíada, que tenha sido desenvolvido por alunas e professoras.

Fiocruz Amazônia prorroga inscrições do edital de seleção para Iniciação Científica, até 30/5
O processo de inscrição é realizado de forma virtual.

Palestra abordará transformação tecnológica acelerada para novas gerações, durante abertura da 19ª Raic da Fiocruz Amazônia
Abertura do evento ocorrerá na próxima segunda-feira, 30/5, às 9h.

Fiocruz inscreve até 31/05 para processo de seleção de Programa de Estágio Curricular
As vagas são destinadas para estudantes de nível superior.

Centro de Estudo apresentará pesquisa e desenvolvimento em doenças negligenciadas no Brasil
As atividades são destinadas a estudantes de graduação e pós-graduação, pesquisadores, professores e trabalhadores da área da Saúde.

Fiocruz Amazônia divulga republicação do edital para seleção do Programa de Iniciação Científica
O Programa de Iniciação Científica da Fiocruz Amazônia tem como objetivos despertar a vocação científica e incentivar novos talentos potenciais entre estudantes de graduação.

Defesa de TCCs marca encerramento da primeira etapa do Curso de Especialização em Saúde Pública em Manacapuru
O objetivo da especialização é formar sanitaristas qualificados na perspectiva interprofissional para gerar novos conhecimentos e atuar no território como espaço privilegiado da saúde pública.
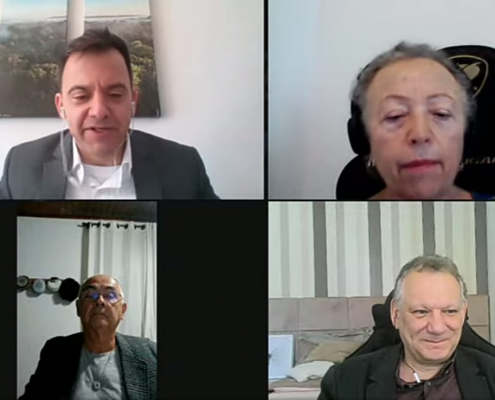
Desafios da comunicação são tema de webinário em comemoração aos 19 anos da Agência Aids de Notícias
Evento discutiu desafios enfrentados ao longo desses anos e o futuro da comunicação de massa sobre temas relacionados à doença.

Curso oferecido à Marinha do Brasil forma agentes multiplicadores em prevenção de IST/HIV/Aids na Amazônia
A segunda formação acontecerá em agosto, na sede do ILMD, com a participação de mais 20 militares.

Fiocruz Amazônia realiza 19ª Reunião Anual de Iniciação Científica
Durante o evento, os bolsistas do PIC-ILMD/Fiocruz Amazônia apresentam os resultados dos projetos desenvolvidos no Programa

Palestra discutirá desafios para implementar a vigilância entomológica no país
A atividade é destinada a estudantes de graduação e pós-graduação, pesquisadores, professores e trabalhadores da área da Saúde.

Projeto da Fiocruz Amazônia avalia condições de saúde da população indígena na Comunidade Parque das Tribos, em Manaus (AM)
35 etnias indígenas que vivem em contexto vulnerável socioambientalmente, nas periferias da capital amazonense participaram do estudo.

Fiocruz realiza curso de formação de agentes multiplicadores em prevenção a IST/HIV/Aids para Marinha
O curso será voltado para médicos, nutricionista, cirurgiões dentistas, enfermeiros e técnicos de enfermagem, que atuam nos atendimentos às comunidades ribeirinhas da Amazônia Legal.

Divulgada lista de candidatos homologados para chamada pública de auxílio à Permanência do Estudante na Pós-Graduação da Fiocruz (APE-PG)
Por meio dessa ação, a Fiocruz busca que seus estudantes se mantenham em seus cursos com um pouco mais de estabilidade.

Palestra irá abordar consumo de bebidas e desfechos cardiometabólicos
Estudo investigou consumo de bebidas alcoólicas e não alcoólicas, segundo variáveis sociodemográficas, de hábitos de vida e localização geográfica.

Estudo avalia saúde sexual e reprodutiva das venezuelanas migrantes em Manaus e Boa Vista
Pesquisa está acontecendo em quatro países da América Latina - Colômbia, México, El Salvador e Brasil - , com financiamento do governo inglês.

Edital Inovação Amazônia vai financiar projetos de pesquisa em Rondônia e no Amazonas
Projetos poderão ter como temáticas a biodiversidade da Amazônia, vigilância, controle e tratamento de doenças tropicais, e/ou negligenciadas ou emergentes na região.

OMS e OPAS reafirmam compromisso de apoiar pesquisas da Fiocruz Amazônia
Pesquisas desenvolvidas pelo ILMD podem dar outras respostas a interrogações que ainda existem sobre a Covid-19.

Programa de Iniciação Científica da Fiocruz Amazônia inscreve até 27/5
O PIC-ILMD/Fiocruz Amazônia é desenvolvido em parceria com a Fundação de Amparo à Pesquisa do Estado do Amazonas (Fapeam).

Palestra irá abordar estudos para decifrar mecanismos de detoxificação do heme e da homeostasia redox no plasmódio
As atividades são destinadas a estudantes de graduação e pós-graduação, pesquisadores, professores e trabalhadores da área da Saúde.

Fiocruz em parceria com Unicef e organizações indígenas fazem encontros para mitigar impactos da Covid nas comunidades.
O projeto é desenvolvido pelo Laboratório de História, Políticas Públicas e Saúde na Amazônia (LAHPSA), do ILMD / Fiocruz Amazônia

Fiocruz Amazônia participa do Programa Papo Cidadão do Ministério Público do Amazonas sobre vacinação de crianças
Felipe Gomes Naveca, coordenador da Vigilância Genômica do SARS-CoV-2 no Amazonas, foi um dos convidados do programa.

Trabalhadores da Fiocruz Amazônia homenageados em comemoração ao Dia do Trabalhador
Iniciativa destacou o dia a dia dos colaboradores, nos diferentes setores da instituição.

Tecnologia desenvolvida na Fiocruz Amazônia será usada pelo MS contra o ‘Aedes aegypti’
Estratégia de controle de vetores da dengue que utiliza estações disseminadoras de larvicidas será incorporada pelo Ministério da Saúde como diretriz nacional

Empossada primeira diretoria da Associação de Pós-Graduandos da Fiocruz Amazônia
Criação da APG Fiocruz Amazônia foi homologada em assembleia geral dos pós-graduandos

Parteiras tradicionais elegem nova diretoria de associação que reúne categoria no Estado e validam guia que as orientará sobre a atividade
Diretoria da entidade tem representantes de diversos municípios do Amazonas e buscará garantir direitos das parteiras em atuação.

Fiocruz Amazônia recebe incentivo do Japão para pesquisas pré-clínica de uma vacina para malária vívax
O ILMD conta com uma plataforma voltada à realização de ensaios para testagem de substâncias, bem como novas formulações vacinais para a malária causada pelo Plasmodium vívax.

Centro de Estudos abordará reflexos da pandemia de Covid-19 na vida de mulheres negras e indígenas
As atividades são destinadas a estudantes de graduação e pós-graduação, pesquisadores, professores e trabalhadores da área da Saúde.

Auxílio à Permanência do Estudante na Pós-Graduação da Fiocruz (APE-PG)
O APE-PG tem por objetivo promover a continuidade nos estudos para discentes de baixa renda, em situação de vulnerabilidade social, nos programas de pós-graduação da Fiocruz

Estudo da Fiocruz analisa relação entre casos de suicídio e desigualdades regionais durante primeira onda da pandemia de Covid-19 no Brasil
Pesquisa levou em conta dados de mortalidade do Ministério da Saúde e foi desenvolvida em parceria pela Fiocruz Amazônia e Fiocruz Ceará.

V Encontro da Rede Unida reúne parteiras da Amazônia e discute contribuições para fortalecimento do SUS
Objetivo do encontro será fomentar discussão em torno de iniciativas voltadas ao cotidiano dos serviços de saúde, instituições de ensino e pesquisa, além das experiências de gestão e participação social.

Divulgado resultado da prova de inglês do processo seletivo para o ProfSaúde
O curso visa formar profissionais aptos a atuarem como preceptores para graduação e residência médica em Saúde da Família

Projeto Manaós recebe propostas para publicação de livro sobre saúde indígena nas cidades
Interessados em participar do projeto editorial terão até o dia 21/4/2022 para submeter manuscritos.

Especialização em gestão de organizações de saúde forma nova turma em Maués
Curso integra o Programa QualificaSUS e concede título de Especialista em Gestão das Organizações Públicas de Saúde aos participantes

Fiocruz lança chamada interna de permanência aos estudantes de pós-graduação de baixa renda
As inscrições vão de 18 a 29 de abril!

Pesquisa internacional demonstra que consumo de carne de caça pode reduzir a anemia em crianças da floresta
Pesquisa avaliou 610 crianças, com idades entre 6 e 59 meses (0,5 a 4,9 anos), de quatro cidades de acesso remoto na Amazônia, incluindo 58 comunidades ribeirinhas.

Centro de Estudos abordará complexidades da dinâmica de malária na Amazônia e estratégias de controle
Palestrante apresentará trabalhos recentes que descrevem a epidemiologia da malária na Amazônia e algumas estratégias de controle.

Fórum de Unidades Regionais acontece na Bahia e tem como foco as populações vulnerabilizadas
Esta é a primeira edição presencial do fórum, realizada após dois anos da pandemia de Covid-19.

Professor doutor Wanderley de Souza (UFRJ) conhece as plataformas de trabalho do ILMD
O objetivo da visita foi conhecer a infraestrutura científica do ILMD, bem como os trabalhos realizados pelas diferentes plataformas que integram a instituição.

ILMD / Fiocruz Amazônia debate sobre conscientização do autismo
Objetivo é realizar programação de eventos ao longo do mês de abril, dedicado à conscientização acerca da causa das pessoas portadoras do transtorno do espectro autista.

Centro de Estudos abordará utilização de jogos como prática de saúde
Palestra irá discutir exemplos que apontam diferentes caminhos e possibilidades na interseção entre jogos e saúde.

Fiocruz defende integração entre instituições e investimento em pesquisa na Amazônia
Criação de linhas de financiamento para pesquisas nas áreas de desenvolvimento tecnológico, inovação e biodiversidade é uma das estratégias de integração

Fiocruz atua em parceria com a coordenação de política de saúde integral das populações do campo, da floresta e das águas da SES-AM
Ações de saúde serão desencadeadas a partir de uma matriz a ser definida pelos dois órgãos.

Divulgado resultado da homologação de inscrições do processo seletivo para o ProfSaúde
Confira resultado da homologação, referente à Chamada Pública Nº 01/2021.

Estudo desenvolvido em parceria pela Fiocruz e Fapeam identifica proteínas diferenciais associadas a lesões precursoras do câncer do colo de útero
Pesquisa foi contemplada pelo edital do Programa Pesquisa para o SUS, Gestão Compartilhada em Saúde (PPSUS), da Fapeam.

Centro de Estudos irá discutir desafios para vigilância de base comunitária indígena em Manaus
Apresentação vai abordar “Projeto-Piloto de Vigilância epidemiológica de base comunitária com o uso das TICs em comunidades indígenas urbanas de Manaus”

Boletim RPT traz perfil de pesquisadora da Fiocruz Amazônia
Valdinete Alves é responsável técnica pela plataforma de PCR em Tempo Real – RPT-09G, instalada no ILMD.

Atividades de ensino do ILMD/Fiocruz Amazônia permanecerão no sistema remoto no primeiro semestre de 2022
As aulas, exames de qualificação, defesas de tese e seminários, permanecerão no ensino remoto

Fiocruz inscreve para estágios até o próximo dia 30/03
As vagas são para estudantes de nível superior (a partir do 6º período) dos cursos de Administração, Engenharia de Produção e Ciências da Computação.

Fiocruz Amazônia retoma ciclo de palestras do Centro de Estudos
Evento discutirá os achados da Rede Genômica Fiocruz e do Laboratório de Referência Nacional no enfrentamento de Influenza e SARS-CoV-2 no período pandêmico.

Aula inaugural da Fiocruz Amazônia irá abordar mudanças climáticas e seus impactos sobre a Amazônia
Os programas, cursos e atividades de ensinos desenvolvidos pela Fiocruz Amazônia visam qualificar profissionais para funções especializadas nos campos das ciências e tecnologias em saúde.

Inova Up irá abordar acesso ao patrimônio genético e ao conhecimento tradicional
O evento conta com o apoio do Instituto Leônidas & Maria Deane (ILMD/Fiocruz Amazônia).
 https://amazonia.fiocruz.br/wp-content/uploads/2022/03/c2e1559b-cc31-41a0-9a6b-469d1e6ecf92.jpg
345
1280
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2022-03-07 18:51:102022-03-07 18:51:15Fiocruz e Rede Unida prorrogam inscrições de trabalhos na área da saúde até 14/3
https://amazonia.fiocruz.br/wp-content/uploads/2022/03/c2e1559b-cc31-41a0-9a6b-469d1e6ecf92.jpg
345
1280
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2022-03-07 18:51:102022-03-07 18:51:15Fiocruz e Rede Unida prorrogam inscrições de trabalhos na área da saúde até 14/3
Fiocruz doa 27 mil máscaras para comunidades indígenas do Amazonas
A distribuição do material tem por objetivo reforçar as ações de prevenção contra a Covid 19, e suas variantes.

Fiocruz libera primeira vacina Covid-19 nacional
A Fundação Oswaldo Cruz, por meio do Instituto de Tecnologia…

Parteiras indígenas participam de oficina promovida pela Fiocruz Amazônia e Disei Manaus
Um grupo de 28 parteiras tradicionais indígenas dos municípios…

Fiocruz Amazônia apresenta projetos no seminário de encerramento do PPSUS
O ILMD teve cinco projetos contemplados com recursos do programa.

Fiocruz capacita conselheiros de saúde indígena por meio de tecnologias de informação
Começam neste domingo, 20/2, as inscrições para o curso de…

Fiocruz apoia criação de Grupo Condutor de ISTs, HIV/Aids e Hepatites Virais no Amazonas
O grupo terá como finalidade promover a retomada das ações de prevenção, controle, diagnóstico e assistência em HIV/Aids.

Programa Centelha 2 da Fapeam inscreve até 16/3
O edital irá apoiar 50 propostas de inovação com até R$60 mil, por projeto, para a geração de empresas de base tecnológicas.

Pesquisadores da Fiocruz fazem alerta sobre PL que flexibiliza adoção de agrotóxicos no país
Para os pesquisadores do Grupo, o PL ainda fragiliza ações desempenhadas pelo SUS.
 https://amazonia.fiocruz.br/wp-content/uploads/2022/02/Visita2.jpg
853
1280
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2022-02-15 22:18:502022-02-16 11:21:54Vice-presidência de Pesquisa da Fiocruz visita instalações do ILMD em Manaus
https://amazonia.fiocruz.br/wp-content/uploads/2022/02/Visita2.jpg
853
1280
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2022-02-15 22:18:502022-02-16 11:21:54Vice-presidência de Pesquisa da Fiocruz visita instalações do ILMD em Manaus
Fiocruz Amazônia inicia programação do Dia Internacional das Mulheres e Meninas na Ciência
Nesta sexta-feira, 11/2, o Instituto Leônidas & Maria Deane…

Mestrado Profissional em Saúde da Família prorroga inscrições
As 237 (duzentas e trinta e sete) vagas oferecidas, serão distribuídas entre as instituições que fazem parte da rede ProfSaúde

Live reúne pesquisadoras para abordar desafios das mulheres na Ciência
A live contará com palestras de pesquisadoras e estudantes de distintas frentes de atuação na pesquisa científica.

Dia Internacional das Mulheres e Meninas na Ciência terá programação na Fiocruz Amazônia
Fiocruz Amazônia realizará uma campanha de mobilização virtual nas redes sociais, em prol do protagonismo de pesquisadoras da unidade.

Fiocruz Amazônia divulga classificação final do processo seletivo para ingresso no mestrado do PPGBIO-Interação
O Curso possui área de concentração em Biologia da Interação Patógeno Hospedeiro.

Fiocruz Amazônia ultrapassa a marca de 5 mil genomas do SARS-CoV-2 disponibilizados para a comunidade científica
O Amazonas é o segundo estado brasileiro em número de…

PPGBIO-Interação divulga resultado final da prova oral
O Curso possui área de concentração em Biologia da Interação Patógeno Hospedeiro

Dia da Visibilidade Trans é marcado pelo lançamento de vídeos de prevenção apresentados pelas mulheres trans e travestis
Assista a série de cinco vídeos do projeto TransOdara - “Estudo de prevalência da sífilis e outras ISTs entre travestis e mulheres transexuais no Brasil: cuidado e prevenção.

Pesquisador do ILMD Fiocruz Amazônia participa de live sobre a terceira onda da Covid-19 em Manaus
Pioneiro em sequenciar o DNA do novo coronavírus no Norte do país, Naveca também é coordenador de um importante estudo que desvendou novas linhagens circulando no Brasil.

Divulgado resultado preliminar da 3ª etapa do processo seletivo para curso de mestrado do PPGBIO-Interação
O Curso possui área de concentração em Biologia da Interação Patógeno Hospedeiro.

Fiocruz Amazônia realiza live sobre aspectos sanitários legais e educacionais da vacinação contra a Covid-19, em crianças no Brasil
Atividade visa promover discussão que integre diferentes aspectos e desafios da vacinação contra a COVID-19 em crianças no país

Fiocruz Amazônia realiza evento pelo mês da Visibilidade Trans
Encontro reafirma compromisso do Instituto com a diversidade e reforça a necessidade de respeito ao movimento trans, promovendo cidadania entre mulheres e homens transexuais.

Fiocruz Amazônia promove live com orientações sobre covid-19 no ambiente de trabalho
A atividade visa compartilhar orientações importantes sobre cuidados necessários para a diminuição dos riscos de infecção no ambiente de trabalho por covid-19.
Vacinação contra a Covid-19 no Brasil completa um ano
O dia 17 de janeiro marca um ano do início da campanha de vacinação contra a Covid-19 no Brasil.
Covid-19: IFF/Fiocruz divulga resultados do estudo VacinaKids
Mais de 80% dos pais querem vacinar os filhos contra a Covid-19, esse foi o resultado do estudo VacinaKids

Fiocruz e Fuham realizam primeiro inquérito de hanseníase no Brasil
Projetos buscam estimar a magnitude das incapacidades físicas de pacientes curados de hanseníase, pós-alta médica, e aperfeiçoar diagnóstico e tratamento na rede pública visando a eliminação da doença.
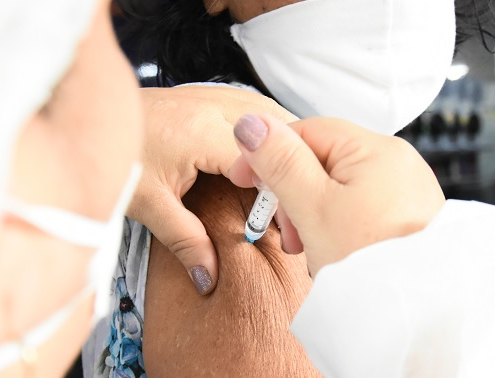
Estudo avalia cobertura vacinal e sua relação com mudanças no padrão de internações e óbitos por Covid-19, em idosos de Manaus
Resultados do estudo reforçam a importância da vacinação, especialmente em contexto epidêmico como o de Manaus.

Fiocruz Amazônia convoca para matrícula institucional dos Programas de pós-graduação Stricto Sensu
Aulas estão previstas para iniciar em março.

NOTA DE PESAR – Thiago de Mello
A diretoria do Instituto Leônidas & Maria Deane (ILMD/Fiocruz…

Pesquisa da Fiocruz Amazônia sobre o monitoramento de animais silvestres e o novo coronavírus é tema de documentário da BBC
O documentário “Forest fear” aborda o surgimento de novas doenças e ressurgimento de outras, a partir do desmatamento da floresta, linha de estudo da pesquisadora Alessandra Nava.

Fiocruz recebe registro da vacina Covid-19 100% nacional
A previsão é de que as primeiras doses do imunizante sejam envasadas ainda em janeiro e entregues ao Ministério da Saúde em fevereiro.

Amazonas confirma primeiro caso da variante Ômicron em Manaus
Informação foi divulgada pela Secretaria de Estado da Saúde, por meio da FVS-RCP, após receber relatório de vigilância genômica emitido pela Fiocruz-Amazônia.

The Lancet: impacto da Covid-19 será mais duradouro em populações vulneráveis
Pesquisa publicada no The Lancet reuniu especialistas para explicar como a queda econômica terá efeito por anos e será pior em países pobres.

Divulgada classificação final do Processo seletivo do Doutorado PPGBIO-Interação
O Curso possui área de concentração em Biologia da Interação Patógeno Hospedeiro

Inscrições abertas para Mestrado Profissional em Saúde da Família (ProfSaúde)
O curso é oferecido na modalidade EaD

Divulgado resultado da 2ª, 3ª etapa e classificação final preliminar para curso de Doutorado do PPGBIO
O Curso possui área de concentração em Biologia da Interação Patógeno Hospedeiro

Diretora da Fiocruz Amazônia e pesquisadores da instituição são agraciados com o Prêmio Sérgio Arouca da Asfoc
Prêmio Sergio Arouca de Saúde e Cidadania é uma homenagem à memória e à obra do sanitarista na defesa da saúde pública no País.

Congresso Nacional de Leptospirose, em Manaus, alerta para subnotificação de casos da doença no Brasil
O evento conta com palestras de autoridades renomadas em saúde pública do País.

Divulgado resultado final do processo seletivo DASPAM
Curso será ministrado em regime integral

Divulgado resultado definitivo da 3ª e 4ª etapas do processo seletivo para Doutorado Acadêmico em Saúde Pública na Amazônia
O Curso será ministrado em regime integral

Delegação da Fiocruz Amazônia participa do IX Congresso Interno da Fiocruz
Processo discute documento guia para a gestão, que explicita o compromisso institucional com a sociedade.

Fiocruz Amazônia divulga classificação final do processo seletivo para o PPGVIDA
O curso de mestrado terá sede em Manaus e será ministrado em regime integral.

Divulgado resultado final da 2ª Etapa para o processo seletivo para curso de mestrado do PPGBIO
O Curso possui área de concentração em Biologia da Interação Patógeno Hospedeiro, e duas linhas de pesquisas

Fiocruz Amazônia, SES-AM e sociedade civil assinam pacto interinstitucional visando fortalecimento da Política de IST/HIV/AIDS e Hepatites Virais
Acordo objetiva fortalecimento da política de IST/HIV/AIDS e Hepatites Virais no Estado

I Congresso Nacional de Leptospirose na Amazônia debaterá as leptospiroses humana, ambiental e animal
Confira a programação do evento.

Divulgado resultado preliminar da 4ª etapa do processo seletivo para Doutorado Acadêmico em Saúde Pública na Amazônia
O Curso será ministrado em regime integral.

“A Aids perdeu a visibilidade”, destaca pesquisadora da Fiocruz
Entrevista relembra grandes feitos da Fiocruz e aborda similaridades entre a epidemia de Aids e a pandemia da Covid-19.

Divulgado resultado da 2ª Etapa para o processo seletivo para curso de mestrado do PPGBIO
O Curso possui área de concentração em Biologia da Interação Patógeno Hospedeiro.

Divulgado resultado da 1ª Etapa para o processo seletivo para curso de Doutorado do PPGBIO
O processo de seleção será realizado em 3 etapas.

Inscrições aberta para o I Congresso Nacional de Leptospirose na Amazônia
A atividade visa a congregação dos profissionais que desenvolvem atividades direta ou indiretamente com leptospirose a nível nacional

Fiocruz Amazônia divulga resultado da 4ª etapa do processo seletivo para o PPGVIDA
O curso de mestrado terá sede em Manaus e será ministrado em regime integral.

Comissão de Seleção publica comunicado sobre Processo Seletivo 2021 do PPGVIDA
O resultado dos recursos da quarta etapa e resultado final da seleção será publicado no dia 09/12

Encontro de pós-graduação vai abordar sindemias, desafios e oportunidades da saúde pública contemporânea no Brasil
Durante o encontro, serão abordadas temáticas como: saúde coletiva, ambiente e sustentabilidade; COVID-19; medicina tropical, saúde mental e a pesquisa científica na pós-graduação.

Divulgada 7ª republicação da chamada pública para curso de Doutorado Acadêmico em Saúde Pública na Amazônia
Nova republicação altera o anexo IV, referente ao cronograma da 3ª e 4ª etapa.

Projeto Manaós promove webnário sobre saúde da população indígena em contextos urbanos
Debate reúne mulheres com grande atuação e representatividade nas discussões sobre a causa indígena.

Divulgada 3ª republicação da Chamada Pública para ingresso no Doutorado Acadêmico do PPGBIO
Republicação prorroga as inscrições do processo seletivo.

Centro de Estudos irá abordar Influência da infecção plasmodial na interação entre os sistemas cognitivos
palestra será apresentada por Cláudio Tadeu Daniel Ribeiro, pesquisador do Instituto Oswaldo Cruz (IOC).

Encontro da Pós-graduação da Fiocruz Amazônia abre votação para concurso de fotografias
No total, 24 fotografias foram enquadradas nos critérios de seleção e disponibilizadas para votação popular.

Divulgado resultado da seleção bolsistas de apoio técnico para Projeto Manaós
Formação no Curso de Atualização ocorre de 29/11 a 4/12.

Fiocruz alerta para impacto da pandemia sobre o tratamento de pessoas vivendo com HIV/Aids
Webinar discutiu efeitos danosos da desinformação gerada pelas fakenews no contexto do sistema de saúde.

Divulgado resultado final da 1ª etapa do processo seletivo para curso de mestrado do PPGBIO-Interação
Todas as etapas serão realizadas em formato virtual.

Projeto da Fiocruz Amazônia lança website Medidas de Saúde Pública contra a Covid-19
A página foi produzida com base no conteúdo na Guia de “Orientações para a aplicação de medidas de saúde pública não farmacológicas a grupos populacionais em situação de vulnerabilidade no contexto da Covid-19”.

Divulgado resultado final da 3ª etapa do Processo Seletivo para curso de mestrado do PPGVIDA
O curso de mestrado será ministrado em Manaus.

Divulgada etapa de homologação de inscrições do mestrado em Biologia da Interação Patógeno Hospedeiro
Análise da documentação e homologação das inscrições.

Inscrições para concurso de fotografia encerram dia 19/11
Critérios para a seleção das fotografias serão: criatividade, originalidade, relevância e conformidade com a categoria escolhida.

Centro de Estudos irá abordar sífilis e outras Infecções sexualmente transmissíveis
Tema será abordado na perspectiva epidemiológica dessas infecções.

Assembleia Legislativa do Amazonas homenageia Marcus Barros, primeiro diretor da Fiocruz Amazônia
Com propositura do deputado estadual Serafim Correa, a ALE-AM concedeu ontem, 16/11, ao médico, pesquisador e professor Marcus Barros, a Medalha Ruy Araújo.

Divulgada 4ª republicação da Chamada Pública Nº 011/2021
Republicação com alterações no item 9.7 e anexo I - cronograma

Divulgada 6ª republicação da chamada pública para curso de Doutorado Acadêmico em Saúde Pública na Amazônia
A nova republicação altera a bibliografia sugerida para a Prova Oral.

Webinar irá discutir desinformação gerada por fakenews sobre Vacinas, HIV e Covid-19
Debate reunirá estudiosos especialistas em HIV Aids, no Brasil.

Projeto Manaós prorroga inscrições do Processo Seletivo de bolsistas de apoio técnico
Inscrições foram prorrogadas até 16/11.

Divulgado cronograma da 4ª etapa do processo seletivo para curso de Doutorado Acadêmico em Saúde Pública na Amazônia
O Curso será ministrado em regime integral.

Inscrições prorrogadas para mestrado em Biologia da Interação Patógeno Hospedeiro
As inscrições foram prorrogadas até 16/10.

Divulgada 2ª republicação da Chamada Pública para ingresso no Doutorado Acadêmico do PPGBIO
Republicação apresenta alterações nos procedimentos de inscrição

Divulgada 3ª republicação da Chamada Pública Nº 011/2021
Republicação apresenta mudanças no cronograma de execução.

Divulgado resultado da 3ª etapa do processo seletivo para curso de Doutorado Acadêmico em Saúde Pública na Amazônia
O Curso será ministrado em regime integral.

Fiocruz Amazônia divulga resultado da 3ª etapa do Processo Seletivo para o mestrado PPGVIDA
O processo de seleção para o PPGVIDA é feito em quatro etapas.

Fiocruz Amazônia divulga resultado final da prova de Saúde Coletiva do processo seletivo para o mestrado PPGVIDA
O curso de mestrado será ministrado em Manaus.

Centro de Estudos irá apresentar pesquisas com selênio para tratamento de cardiopatia
As atividades são destinadas a estudantes de graduação e pós-graduação, pesquisadores, professores e trabalhadores da área da Saúde.

Divulgada nova republicação da chamada pública para curso de Doutorado Acadêmico em Saúde Pública na Amazônia
A Republicação altera o cronograma da 3ª e da 4ª Etapas do processo seletivo para o curso de Doutorado Acadêmico em Saúde Pública na Amazônia.

Divulgado resultado da 2ª etapa do processo seletivo para curso de Doutorado Acadêmico em Saúde Pública na Amazônia
Concorrem às vagas, brasileiros natos ou com dupla nacionalidade ou estrangeiros com visto permanente.

E-book da Fiocruz apresenta diagnóstico da evolução da pandemia no Brasil
E-book segue linha cronológica para traçar as primeiras estratégias de combate ao espalhamento da doença

Projeto Manaós abre inscrições para Processo Seletivo de bolsistas de apoio técnico
A bolsa é destinada a jovens indígenas.

Fiocruz publica nota em defesa da ciência e de pesquisadores
Presidência da Fundação Oswaldo Cruz (Fiocruz) vem a público manifestar seu apoio aos pesquisadores da Fiocruz Amazônia

Inscrições para mestrado em Biologia da Interação Patógeno Hospedeiro ocorrem até 12 de novembro
Estão sendo oferecidas 9 vagas para ingresso no curso

Divulgada republicação da Chamada Pública para ingresso no Doutorado Acadêmico do PPGBIO
O Curso possui área de concentração em Biologia da Interação Patógeno Hospedeiro, e duas linhas de pesquisas

Encontro da pós-graduação da Fiocruz Amazônia inicia no dia 30/11
O Encontro é destinado a pesquisadores, alunos de pós-graduação e de iniciação científica, e profissionais de saúde.

Palestra irá abordar desafios de controle da malária nos garimpos em fronteira internacional
Palestra vai analisar empecilhos para eliminação da malária em populações de difícil acesso pelos serviços de saúde locais.

Divulgado resultado da 2ª etapa do processo seletivo para curso de Doutorado Acadêmico em Saúde Pública na Amazônia
O Curso será ministrado em regime integral

Fiocruz Amazônia divulga resultado da prova de Saúde Coletiva do processo seletivo para o mestrado PPGVIDA
O processo de seleção para o PPGVIDA é feito em 4 etapas. A prova de Saúde Coletiva refere-se à segunda etapa.

Divulgado resultado dos pedidos de isenção da taxa de inscrição para o processo seletivo do curso de doutorado do PPGBIO
O Curso possui área de concentração em Biologia da Interação Patógeno Hospedeiro, e duas linhas de pesquisas
Carta da presidente da Fiocruz celebra Dia do Servidor Público
"Só é possível promover saúde, ciência e cidadania no país com serviços públicos qualificados e servidores valorizados" - Nísia Trindade Lima

Fiocruz Amazônia apresenta novos membros do Conselho Deliberativo
Novos membros representam as áreas de Pesquisa, Ensino e Gestão da Fiocruz Amazônia, eleitos para o biênio 2021-2023.

Palestra irá abordar engenharia de proteínas e aplicações biotecnológicas
Abordagem pretende auxiliar estudantes de pós-graduação na realização de suas pesquisas,

Curso de Urgências e Emergências Obstétricas inicia com alunos de todos os estados da Região Norte
O curso iniciou 1431 alunos matriculados. A atividade acontece pelo Ambiente Virtual de Aprendizagem do Campus Virtual da Fiocruz (AVA-Fiocruz).

Divulgado resultado final da 1ª etapa do processo seletivo para curso de Doutorado Acadêmico em Saúde Pública na Amazônia
O Curso será ministrado em regime integral.

Estudo investiga soroprevalência de SARS-CoV-2 e fatores associados em Manaus
Pesquisa objetiva estimar a distribuição e perfil de casos de COVID-19 na população de Manaus

Divulgada 4ª Republicação de Chamada Pública para processo seletivo do Doutorado Acadêmico em Saúde Pública na Amazônia
Republicação apresenta alteração no cronograma da 2ª etapa: prova de saúde coletiva.
Fiocruz Amazônia promove movimento preparatório para IX Congresso Interno da Fiocruz
As atividades do Congresso Interno são realizadas a cada quatro anos

Fiocruz Amazônia divulga resultado final das inscrições homologadas para curso de mestrado do PPGVIDA
O curso de mestrado terá sede em Manaus e será ministrado em regime integral

Fiocruz Amazônia promove encontro com parceiros em projetos de pesquisa e em ações de ensino
Para fortalecer a interação com as instituições e ampliar a capacidade de articulação do Instituto.

Congresso Interno foi tema de encontro na Fiocruz Amazônia
O lema deste Congresso Interno é Desenvolvimento sustentável com equidade, saúde e democracia: a Fiocruz e os desafios para o SUS e a saúde global.

Unidades da Fiocruz no Amazonas e Rondônia traçam ações de cooperação Institucional
Entre as ações definidas na reunião, está a realização de um seminário entre instituições de ensino e pesquisa da Amazônia.

Palestra irá abordar causas sociais das iniquidades em saúde
Serão discutidos os principais mecanismos pelos quais as desigualdades sociais influenciam os diferentes desfechos em saúde.

Fiocruz Amazônia divulga inscrições homologadas para curso de mestrado do PPGVIDA
O curso de mestrado terá sede em Manaus e será ministrado em regime integral.

A abertura do curso Urgências e Emergências Obstétricas acontece nesta quarta, 20/10
Nesta quarta-feira, 20/10, A atividade pode ser acompanhada pelo YouTube, às 9h, horário Manaus.

Fiocruz Amazônia lança edital para ingresso em curso de doutorado
O processo de seleção será realizado em 3 etapas

Divulgado resultado da 1ª etapa do processo seletivo para Doutorado em Saúde Pública na Amazônia
O Curso será ministrado em regime integral.

Fiocruz Amazônia e SES-AM discutem ações compartilhadas no campo das IST/HIV/HV
Para ações de ensino e capacitação de profissionais de saúde que atuam prevenção e saúde de pessoas com Infecções Sexualmente Transmissíveis e hepatites virais.

Fiocruz Amazônia realiza Oficina de Troca de Saberes, em Tabatinga-AM
De segunda a quarta-feira (18 a 20/10) a Oficina de Troca de Saberes e Experiências entre Parteiras Tradicionais e Equipe Multidisciplinar de Saúde Indígena, no Polo Base Belém do Solimões.

Fiocruz Amazônia realiza Oficina de Troca de Saberes, em Maués-AM
Nos dias 14 e 15 de outubro, de 8h às 17h, no Museu do Homem, em Maués (AM), a Oficina de Troca de Saberes do Projeto Redes Vivas.

Palestra irá abordar relação da infecção pelo Toxoplasma gondii e interferência sobre neurotransmissores
As atividades são destinadas a estudantes de graduação e pós-graduação, pesquisadores, professores e trabalhadores da área da Saúde.

Fiocruz Amazônia lança edital para o curso de mestrado em Biologia da Interação Patógeno Hospedeiro
Inscrições podem ser feitas no período de 21 de outubro a 12 de novembro.

Inscrições para o Curso de Doutorado em Saúde Pública na Amazônia prorrogadas até quarta-feira, 13/10
Estão sendo oferecidas 18 vagas, e o processo seletivo será feito em quatro etapas.

Palestra irá abordar violência contra crianças e adolescentes na Estratégia Saúde da Família
Pesquisadora irá apresentar os resultados de um inquérito epidemiológico realizado em Manaus

Estudo avalia letalidade hospitalar por COVID-19 em quatro capitais do Brasil e possível relação com variante Gama
Este é o primeiro estudo que descreve a letalidade hospitalar e em UTI da COVID-19, em cenários com e sem circulação da variante Gama (P.1).

Imunizante AstraZeneca será usado no estudo CovacManaus 2
As doses de vacina AstraZeneca que serão utilizadas para o estudo foram doadas pelo Instituto de Tecnologia em Imunobiológicos (Bio-Manguinhos).

Fiocruz Amazônia recebe 167ª Reunião da Mesa Diretora do Conselho Nacional de Saúde
A reunião da mesa diretora integra a agenda do CNS em Manaus.

Programação da Semana Nacional de Ciência e Tecnologia na Fiocruz
A Fiocruz oferece atividades ao vivo de 4 a 8 de outubro, e gravadas no decorrer desse mês.

Palestra irá discutir responsabilidade social do cientista e ameaças ao desenvolvimento científico no Brasil
A atividade é destinada a estudantes de graduação e pós-graduação, pesquisadores, professores e trabalhadores da área da Saúde.

Divulgada 2ª. Republicação do edital para ingresso no Curso de Doutorado em Saúde Pública na Amazônia
A segunda Republicação do edital altera o item 5. XI (Projeto de Pesquisa).

Resultado dos pedidos de isenção para ingresso no Curso de Doutorado em Saúde Pública na Amazônia
Inscrições podem ser feitas até 8 de outubro.

Oficina sobre saberes e conhecimentos tradicionais para lideranças indígenas
A Oficina Valorizando os Saberes e Conhecimentos Tradicionais: Colóquios sobre as Vivências e Experiências Étnico-Culturais Indígenas será no sábado, 25/9, das 8h30 às 12h.

Republicação do edital para ingresso no Curso de Doutorado em Saúde Pública na Amazônia
A Republicação prorroga para 23/9 pedido de isenção da taxa de inscrição e altera o cronograma.

Palestra irá abordar foco de malária zoonótica humana na Mata Atlântica Fluminense
A atividade é destinada a estudantes de graduação e pós-graduação, pesquisadores, professores e trabalhadores da área da Saúde.

Livro aborda arte do cuidado em saúde voltado à população ribeirinha
A obra analisa o ponto de vista dos usuários do sistema público de saúde e ainda do serviço ofertado.

Divulgado resultado dos pedidos de isenção da taxa de inscrição para o processo seletivo do PPGVIDA
Inscrições podem ser feitas no período de 20 de setembro a 18 de outubro

Palestra irá abordar Impacto da contaminação por mercúrio na saúde do povo Munduruku
Estudo avaliou impactos da contaminação por mercúrio, em 200 indígenas, de três aldeias na Terra Indígena Sawré Muybu.

Fiocruz Amazônia lança edital para o curso de mestrado em Condições de Vida e Situações de Saúde na Amazônia
Estão sendo oferecidas 17 vagas para ingresso no curso no ano de 2022. As vagas estão distribuídas nas duas linhas de pesquisa do PPGVIDA.

Abertas as inscrições para o curso Urgências e Emergências Obstétricas
Estão sendo oferecidas 500 vagas destinadas a profissionais do Amazonas e de Roraima que atuam na assistência ao ciclo gravídico-puerperal.
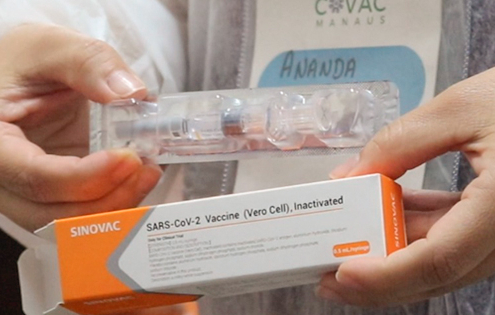
Estudo CovacManaus divulga dados preliminares
Entre os vacinados, 91% apresentaram anticorpos detectáveis após a 1ª dose e 99,8% após a 2ª dose.

NOTA DE REPÚDIO
O ILMD/Fiocruz Amazônia trabalha ativamente na busca da melhoria da saúde e qualidade de vida da população LGBTIQA+

Palestra irá apresentar modelo para estudos de infecção por Leishmania
As atividades são destinadas a estudantes de graduação e pós-graduação, pesquisadores, professores e trabalhadores da área da Saúde.

2ª. NOTA DE ESCLARECIMENTO
O ILMD/Fiocruz Amazônia reitera seu compromisso com a saúde pública, em especial das populações da Amazônia.

Parteiras tradicionais do Amazonas instituem legalmente associação Algodão Roxo
O evento organizado pelo Laboratório de História, Políticas Públicas e Saúde na Amazônia (Lahpsa) sendo um desdobramento do Projeto Redes Vivas.

NOTA DE ESCLARECIMENTO
Após a devolução, o ILMD/Fiocruz Amazônia não se responsabiliza pelo uso da embarcação pela empresa proprietária.

Centro de Estudos vai abordar atual momento da pandemia de COVID-19
Apresentação apontará fatores que devem tornar o SARS-CoV2 menos letal.
Alunos do Programa de Iniciação Científica iniciam suas atividades na Fiocruz Amazônia
O PIC-ILMD/Fiocruz Amazônia é apoiado pela Fapeam e pelo CNPq.

Fiocruz lança edital para ingresso em Curso de Doutorado em Saúde Pública na Amazônia
Estão sendo oferecidas 18 vagas distribuídas em duas linhas de pesquisa.
Fiocruz Amazônia realiza Seminário Interno da Pesquisa
O evento foi direcionado ao público interno do ILMD/Fiocruz Amazônia e transmitido pela Plataforma Teams.

Fiocruz Amazônia prepara acolhida para novos alunos de Iniciação Científica
A acolhida dos alunos do PIC será na próxima terça-feira, 31/8, de 9h às 12h. Evento virtual.

Divulgada a lista dos selecionados para a oficina “OuvirCiência”
A atividade integra a Semana Nacional de Ciência e Tecnologia (SNCT) no ILMD/Fiocruz Amazônia.

Centro de Estudos terá palestra sobre filárias e vetores do Amazonas
A palestra será proferida pelo pesquisador Túllio Romão Ribeiro da Silva, do ILMD/Fiocruz Amazônia.

Variante Delta e a situação do SUS na pandemia foi tema de audiência interativa
A Cexcorvi realizou em 24/8 audiência interativa para debater a Variante Delta do Coronavírus e a Situação Atual do SUS Perante a Pandemia.

Projeto Redes Vivas promove encontro de parteiras tradicionais
A Reunião é um desdobramento do Projeto Redes Vivas, do Lahpsa-ILMD/Fiocruz Amazônia.

Fiocruz Amazônia recebe visita de parlamentar
A visita teve como objetivo conhecer as demandas institucionais para futuras emendas.

Sai a lista dos selecionados para a oficina “DigiCiência”
A atividade marca o início da Semana Nacional de Ciência e Tecnologia (SNCT) no ILMD/Fiocruz Amazônia.

Inscrições para oficinas de divulgação científica podem ser feitas até o dia 22/8
As atividades são para bolsistas de iniciação científica, alunos de pós-graduação e pesquisadores interessados.

Fiocruz Amazônia completa 27 anos em Manaus
Ao completar 27 anos, uma nova direção assume a instituição, para o quadriênio 2021-2025.

Centro de Estudos terá palestra sobre Leishmania
“Efeito da acetilação proteica no processo de diferenciação das formas evolutivas de Leishmania mexicana” é o tema desta semana.

Adele Benzaken é empossada diretora da Fiocruz Amazônia
Adele exercerá a Direção no quadriênio 2021-2025

Fiocruz Amazônia abre inscrições para oficina de divulgação científica por meio de vídeos e podcasts
As inscrições iniciam nesta segunda-feira, 16/8 e ocorrem até 19/8

Projeto estuda papel dos anticorpos do leite materno na proteção contra COVID-19
Pesquisadores procuram voluntárias puérperas para participar da pesquisa.

Fiocruz Amazônia promove encontro de pesquisadores em saúde na tríplice fronteira
Encontro visa discutir possibilidades de articulação e futuros acordos interinstitucionais.

Fiocruz Amazônia realiza solenidade de transmissão do cargo de Direção Institucional
Considerando os protocolos de biossegurança, a solenidade será transmitida via web.
Fiocruz Amazônia realiza ação para mapear circulação de variantes no Alto Solimões, no AM
No local, são oferecidos testes rápidos de antígeno, exames de PCR e coleta de sorologia para diagnóstico de Covid-19.

Palestra vai abordar descobertas no entendimento da resposta diversa de populações de Manaus e Belo Horizonte às infecções arbovirais
Resultados evidenciam diversidade de respostas que mosquitos podem apresentar às essas infecções virais

Palestra vai abordar trabalho e gestão em saúde na Pandemia de COVID-19, em Manaus
Apresentação discutirá experiências de trabalhadores e usuários
 https://amazonia.fiocruz.br/wp-content/uploads/2021/07/centro-de-estudos_30072021_TopoMateria.jpg
315
828
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2021-07-28 17:26:252021-07-28 17:26:25Centro de Estudos irá abordar estudos translacionais em COVID-19
https://amazonia.fiocruz.br/wp-content/uploads/2021/07/centro-de-estudos_30072021_TopoMateria.jpg
315
828
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2021-07-28 17:26:252021-07-28 17:26:25Centro de Estudos irá abordar estudos translacionais em COVID-19 https://amazonia.fiocruz.br/wp-content/uploads/2021/06/chamada_publica_ppgbio_doutorado_828x315.png
315
830
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2021-07-23 15:36:452021-07-23 15:36:46Divulgado resultado final dos Classificados no Processo Seletivo da Chamada Pública 009/2021
https://amazonia.fiocruz.br/wp-content/uploads/2021/06/chamada_publica_ppgbio_doutorado_828x315.png
315
830
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2021-07-23 15:36:452021-07-23 15:36:46Divulgado resultado final dos Classificados no Processo Seletivo da Chamada Pública 009/2021
Centro de Estudos irá abordar resistência a inseticidas em populações de vetores no Brasil
A palestra vai discutir resultados sobre a genotipagem de mutações kdr
 https://amazonia.fiocruz.br/wp-content/uploads/2021/06/chamada_publica_ppgbio_doutorado_828x315.png
315
830
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2021-07-20 15:56:422021-07-21 10:56:19Doutorado Acadêmico em Biologia da Interação Patógeno Hospedeiro divulga resultado preliminar
https://amazonia.fiocruz.br/wp-content/uploads/2021/06/chamada_publica_ppgbio_doutorado_828x315.png
315
830
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2021-07-20 15:56:422021-07-21 10:56:19Doutorado Acadêmico em Biologia da Interação Patógeno Hospedeiro divulga resultado preliminar
kits de assistência para o parto são doados à Associação das Parteiras Tradicionais do Amazonas
Além dos kits, foram doados aventais descartáveis e cartilhas informativas para as parteiras da APTAM- Algodão Roxo.
 https://amazonia.fiocruz.br/wp-content/uploads/2021/07/boletim_extraordinario_2021_julho.jpg
315
828
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2021-07-16 17:31:542021-07-16 17:33:04Boletim aponta queda nos indicadores de Covid-19
https://amazonia.fiocruz.br/wp-content/uploads/2021/07/boletim_extraordinario_2021_julho.jpg
315
828
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2021-07-16 17:31:542021-07-16 17:33:04Boletim aponta queda nos indicadores de Covid-19
Divulgado cronograma da 2ª etapa da Chamada Pública nº 009/2021
O curso possui área de concentração em Biologia da Interação Patógeno Hospedeiro
 https://amazonia.fiocruz.br/wp-content/uploads/2021/07/centro-de-estudos_16072021_TopoMateria-1.jpg
315
828
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2021-07-14 16:34:002021-07-14 16:34:01Centro de Estudos irá abordar cotidiano dos serviços às notas de pesquisa
https://amazonia.fiocruz.br/wp-content/uploads/2021/07/centro-de-estudos_16072021_TopoMateria-1.jpg
315
828
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2021-07-14 16:34:002021-07-14 16:34:01Centro de Estudos irá abordar cotidiano dos serviços às notas de pesquisa
Inscrições abertas para bolsista de pós-doutorado
Inscrições abertas para bolsista de pós-doutorado no âmbito do Programa de Desenvolvimento da Pós-Graduação (PDPG - Amazônia Legal).

Fiocruz Amazônia divulga candidatos selecionados para disciplinas do segundo semestre de 2021
Lista de candidatos selecionados como aluno especial das disciplinas oferecidas para o segundo semestre.

Inscrições homologadas para a Chamada Pública nº 009/2021
Divulgação das inscrições homologadas para o Curso de Doutorado Acadêmico do Programa de Pós -Graduação Stricto Sensu em Biologia da Interação Patógeno Hospedeiro.
 https://amazonia.fiocruz.br/wp-content/uploads/2021/07/Centro-de-Estudos_09072021_TopoMateria.jpg
315
828
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2021-07-07 18:15:292021-07-07 18:16:49Palestra irá abordar marcadores de alimentação saudável e não saudável no Amazonas
https://amazonia.fiocruz.br/wp-content/uploads/2021/07/Centro-de-Estudos_09072021_TopoMateria.jpg
315
828
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2021-07-07 18:15:292021-07-07 18:16:49Palestra irá abordar marcadores de alimentação saudável e não saudável no Amazonas
Fiocruz Amazônia divulga oferta de disciplinas para Programas de Pós-Graduação Stricto Sensu
As inscrições ocorrerão entre os dias 1 e 5 de julho de 2021.

Centro de Estudos da Fiocruz Amazônia vai abordar “Estrutura e dinâmica de redes de interação”
Palestra irá apresentar a metodologia de Análise do Discurso, a partir de uma aplicação prática.
 https://amazonia.fiocruz.br/wp-content/uploads/2021/06/chamada_publica_ppgbio_doutorado_828x315.png
315
830
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2021-06-28 16:29:402021-06-28 16:29:40Divulgado resultado dos Pedidos de Isenção da Chamada Pública 009/2021
https://amazonia.fiocruz.br/wp-content/uploads/2021/06/chamada_publica_ppgbio_doutorado_828x315.png
315
830
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2021-06-28 16:29:402021-06-28 16:29:40Divulgado resultado dos Pedidos de Isenção da Chamada Pública 009/2021
Perfil hematológico de gestantes com suspeita de infecção por Zika será tema do Centro de Estudos
O Centro de Estudos será na próxima sexta-feira, 25/6, às 10h (horário Manaus).

Nota de Pesar
Victor Py Daniel era pesquisador aposentado do Inpa, atuava nas áreas de entomologia e saúde indígena

Republicação da Chamada Pública Nº 009/2021 para ingresso em curso de doutorado
Correções no cronograma e link de pedido de isenção. A Chamada é para ingresso no doutorado em Biologia da Interação Patógeno Hospedeiro.

Fiocruz Amazônia lança chamada pública para ingresso em curso de doutorado
O curso possui área de concentração em Biologia da Interação Patógeno Hospedeiro, e duas linhas de pesquisas.

Centro de Estudos desta semana vai abordar parasitos do gênero Leishmania
Serão abordados alguns estudos sobre parasitos do gênero Leishmania e diferentes aspectos da sua interação com os hospedeiros.

Fiocruz Amazônia lamenta a morte do pesquisador Antonio Ivo de Carvalho
O médico e pesquisador Antonio Ivo de Carvalho coordenava o Centro de Estudos Estratégicos da Fundação Oswaldo Cruz.

Fiocruz Amazônia divulga resultado do Programa de Iniciação Científica
Resultado do processo seletivo para bolsas do PIC-ILMD, Edição 2021- 2022.

Determinantes sociais da saúde bucal em crianças é o tema do Centro de Estudos desta semana
A palestra será ministrada na sexta-feira, 11/6, pela professora da Universidade Federal do Amazonas (Ufam), Maria Augusta Bessa Rebelo.
Inscrições para o Programa Educacional de Vigilância em Saúde nas Fronteiras vão até o dia 18 de junho
Seleção para cursos de mestrado e doutorado em parceria com o Ministério da Saúde e a Opas
 https://amazonia.fiocruz.br/wp-content/uploads/2021/05/IMG_2168.jpg
315
828
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2021-05-26 23:59:002021-05-27 00:24:42Fiocruz Amazônia prorroga inscrições para Programa de Iniciação Científica
https://amazonia.fiocruz.br/wp-content/uploads/2021/05/IMG_2168.jpg
315
828
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2021-05-26 23:59:002021-05-27 00:24:42Fiocruz Amazônia prorroga inscrições para Programa de Iniciação Científica https://amazonia.fiocruz.br/wp-content/uploads/2021/05/centro-de-estudos_28052021_topoMateria.jpg
315
828
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2021-05-26 15:09:482021-05-26 15:09:50Centro de Estudos irá abordar dinâmica de transmissão de vírus por mosquitos na interface urbano-floresta, em Manaus
https://amazonia.fiocruz.br/wp-content/uploads/2021/05/centro-de-estudos_28052021_topoMateria.jpg
315
828
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2021-05-26 15:09:482021-05-26 15:09:50Centro de Estudos irá abordar dinâmica de transmissão de vírus por mosquitos na interface urbano-floresta, em Manaus
Estudo publicado na Nature Medicine aponta causas dos picos da Covid-19 no Amazonas
O crescimento da Covid-19 foi impulsionado por uma combinação de diminuição das medidas de distanciamento social e pelo surgimento da P.1

Programa Educacional de Vigilância em Saúde nas Fronteiras recebe inscrições até 18 de junho
O VigiFronteiras-Brasil é gratuito. Estão sendo oferecidas 75 vagas para os cursos de mestrado e de doutorado.
 https://amazonia.fiocruz.br/wp-content/uploads/2021/05/thumbnail_Centro-de-Estudos_21052021_TopoMateria.jpg
315
828
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2021-05-19 14:16:402021-05-19 14:16:41Estratégias metodológicas para pesquisas na área da saúde serão abordadas no Centro de Estudos
https://amazonia.fiocruz.br/wp-content/uploads/2021/05/thumbnail_Centro-de-Estudos_21052021_TopoMateria.jpg
315
828
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2021-05-19 14:16:402021-05-19 14:16:41Estratégias metodológicas para pesquisas na área da saúde serão abordadas no Centro de Estudos https://amazonia.fiocruz.br/wp-content/uploads/2021/05/thumbnail_Aula-Inaugural-Esp_em_Saude_Publica_Manacapuru_TopoMat.jpg
315
828
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2021-05-19 14:11:282021-05-19 14:12:45Fiocruz Amazônia promove aula inaugural do Curso de Especialização em Saúde Pública, turma de Manacapuru/AM
https://amazonia.fiocruz.br/wp-content/uploads/2021/05/thumbnail_Aula-Inaugural-Esp_em_Saude_Publica_Manacapuru_TopoMat.jpg
315
828
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2021-05-19 14:11:282021-05-19 14:12:45Fiocruz Amazônia promove aula inaugural do Curso de Especialização em Saúde Pública, turma de Manacapuru/AM
Fiocruz Amazônia conta com novo espaço para estacionamento
Localizado ao lado do anexo da atual sede da Unidade.

Fiocruz Amazônia promove ciclo de palestras sobre controle de doenças transmitidas por vetores na Amazônia
As palestras são online e acontecem de 18 a 27 de maio.
 https://amazonia.fiocruz.br/wp-content/uploads/2021/05/centro-de-estudos_14052021_TopoMateria.png
315
828
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2021-05-12 11:49:412021-05-12 11:50:32Palestra vai abordar metodologia de Análise do Discurso a partir de aplicação em pesquisa de foco psicossocial
https://amazonia.fiocruz.br/wp-content/uploads/2021/05/centro-de-estudos_14052021_TopoMateria.png
315
828
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2021-05-12 11:49:412021-05-12 11:50:32Palestra vai abordar metodologia de Análise do Discurso a partir de aplicação em pesquisa de foco psicossocial
NOTA DE PESAR
A direção da Fiocruz Amazônia lamenta a morte do pesquisador do Inpa, Wanderli Pedro Tadei, ocorrido hoje, 11/5, na cidade de São José do Rio Preto (SP).

Estudo investiga excesso de mortes por causas respiratórias durante a pandemia
Pesquisadores apontam excesso de mortes de 312%.

Fiocruz Amazônia abre inscrições para Programa de Iniciação Científica
Os candidatos têm até o dia 26 de maio para fazerem suas inscrições.

Famílias indígenas fortemente impactadas pela pandemia
Estudo conduzido pela Fiocruz em oito regiões da Amazônia levantou informações relevantes sobre o perfil e as práticas de jovens indígenas

Conselho deliberativo homologa resultado da eleição do ILMD/Fiocruz Amazônia
A candidata Adele Schwartz Benzaken obteve um percentual de 94,8% dos votos válidos.

Pesquisa sobre hemoparasitos em lagartos da Amazônia Central será apresentada no Centro de Estudos
Estudo apresenta dados que poderão embasar futuros estudos taxonômicos, ecológicos e evolutivos.

Comissão Eleitoral da Fiocruz Amazônia divulga link para acompanhar apuração dos votos
Transmissões pelo Zoom e pelo Canal do YouTube da Asfoc-SN

Comissão Eleitoral da Fiocruz Amazônia vai transmitir zerésima
Transmissão ocorrerá nesta sexta-feira, 30/4, às 15h (horário Manaus).

Novo boletim epidemiológico apresenta dados de um ano da pandemia de Covid-19 na tríplice fronteira
As análises vão desde a ocorrência do primeiro caso de Covid-19 em Manaus, em 13 de março de 2020, até o dia 31 de março de 2021.

Centro de Estudos vai abordar epidemiologia de SARS-CoV-2 no Amazonas
Pesquisadora apresentará linha do tempo do projeto DETECTCoV-19: história, fatos e dados.

Inscrições para a especialização em Saúde Pública em Manacapuru (AM) podem ser feitas até o dia 28/4
O Instituto Leônidas & Maria Deane (ILMD/Fiocruz Amazônia),…

Comissão Eleitoral do ILMD/Fiocruz Amazônia informa sobre 2º. Debate
A Comissão Eleitoral instituída para organizar e coordenar…

Comissão Eleitoral divulga boletim eletrônico de candidata
Comissão divulga boletim eletrônico, de responsabilidade e autoria da candidata Adele Schwartz Benzaken

Fiocruz Amazônia abre processo seletivo simplificado para bolsista de pós-doutorado
As inscrições iniciam na próxima segunda-feira, 26/4

Divulgada republicação de chamada pública para atualização em organização de protocolo para combate à Covid-19
A republicação traz alteração do Anexo I, referente ao aumento no número de turmas e vagas ofertadas.

Centro de Estudos aborda metodologia utilizada em pesquisas na área da saúde
O debate incluirá uma discussão sobre suas possibilidades de uso e alguns aspectos práticos de sua aplicação.

Fiocruz Amazônia abre inscrições para curso de atualização em organização de protocolo para combate à Covid-19
A oferta deste curso de Atualização é parte integrante das ações de Educação previstas no Projeto QualificaSUS do ILMD.

Fiocruz Amazônia homologa candidatura para cargo de direção
A Comissão Eleitoral informa que não recebeu nenhum pedido de impugnação de candidato inscrito.

Novas espécies de maruins são encontradas em área da BR-174 no Amazonas
As novas espécies foram encontradas na área do Projeto de Assentamento Rio Pardo, que fica na BR-174, onde funciona uma base de apoio às pesquisas da Fiocruz Amazônia

Campanha eleitoral na Fiocruz Amazônia inicia em 19/4
A Comissão Eleitoral informa que não recebeu nenhum pedido de impugnação de candidato inscrito.

Palestra do Centro de Estudos vai abordar malária em primatas não-humanos
Apresentação vai abordar a infecção por espécies de Plasmodium em macacos de diferentes espécies.

Vulnerabilidade ambiental da Amazônia pode contribuir para o surgimento de novas doenças
O alerta para o possível aparecimento de outras epidemias emergentes e reemergentes ocorre diante das interferências que a Amazônia e outros biomas brasileiros vêm sofrendo.

Comissão Eleitoral da Fiocruz Amazônia divulga nome de candidata inscrita para o cargo de Diretora
A Comissão Eleitoral instituída para organizar e coordenar os trabalhos relativos à eleição para o cargo de Diretor do Instituto Leônidas & Maria Deane (ILMD/Fiocruz Amazônia).

Fiocruz Amazônia promove palestra sobre utilização de fungos endofíticos como fonte de substâncias bioativas
Apresentação vai abordar estudos realizados pelo grupo de pesquisa Química Aplicada à Tecnologia da Escola Superior de Tecnologia da UEA.

Inscrições abertas para o Programa Educacional de Vigilância em Saúde na Fronteiras
Cursos gratuitos de mestrado e doutorado. Projeto em parceria com o Ministério da Saúde e Opas. Inscrições até o dia 30 de abril

Fiocruz lamenta falecimento do pesquisador-emérito José Rodrigues Coura
A Presidência da Fiocruz lamenta profundamente o falecimento, neste sábado (3/4), do médico e pesquisador José Rodrigues Coura.

Fiocruz Amazônia abre inscrições para curso de especialização em Saúde Pública no município de Manacapuru – AM
As inscrições iniciam na próxima segunda-feira, 5/4.

Comissão Eleitoral para eleição de diretor 2021/2025 disponibiliza formulários para inscrição
A Comissão Eleitoral disponibiliza formulários para inscrição dos candidatos.

Especificidades do suicídio entre indígenas no Brasil será tema de palestra do Centro de Estudos
O assunto será abordado pelo pesquisador Maximiliano Ponte de Souza, da Fiocruz Ceará, na sexta-feira, 26/3, às 10h.

Fiocruz Amazônia divulga edital para eleição de diretor 2021/2025
Aprovado nesta terça-feira, 23/3, pela Comissão Eleitoral, o Regulamento Eleitoral para o cargo de Diretor
 https://amazonia.fiocruz.br/wp-content/uploads/2021/03/79af1ea6-3e9e-44e4-a5fe-29ede06f7f7f.jpg
315
828
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2021-03-23 09:46:342021-03-23 11:20:04Rede Genômica Fiocruz detecta alterações inéditas na proteína Spike do Sars-CoV-2 no Brasil
https://amazonia.fiocruz.br/wp-content/uploads/2021/03/79af1ea6-3e9e-44e4-a5fe-29ede06f7f7f.jpg
315
828
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2021-03-23 09:46:342021-03-23 11:20:04Rede Genômica Fiocruz detecta alterações inéditas na proteína Spike do Sars-CoV-2 no Brasil
Inscrições abertas para os cursos do Programa Educacional de Vigilância em Saúde na Fronteiras da Fiocruz
Profissionais de saúde podem participar gratuitamente dos cursos de mestrado e doutorado. Inscrições até o dia 30 de abril .
 https://amazonia.fiocruz.br/wp-content/uploads/2021/03/chamada_publica_004_2021_TopoMateria.png
315
828
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2021-03-19 19:00:012021-03-19 19:07:49PPGBIO-Interação abre inscrições até 23/3 para seleção de bolsista de Apoio Técnico
https://amazonia.fiocruz.br/wp-content/uploads/2021/03/chamada_publica_004_2021_TopoMateria.png
315
828
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2021-03-19 19:00:012021-03-19 19:07:49PPGBIO-Interação abre inscrições até 23/3 para seleção de bolsista de Apoio Técnico https://amazonia.fiocruz.br/wp-content/uploads/2021/03/EE44B355-6513-4CF9-AFB0-C11CDF71EA31.png
924
1640
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2021-03-19 16:16:402021-03-22 11:34:29InfoGripe aponta tendência de crescimento da Covid-19 em todos os estados
https://amazonia.fiocruz.br/wp-content/uploads/2021/03/EE44B355-6513-4CF9-AFB0-C11CDF71EA31.png
924
1640
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2021-03-19 16:16:402021-03-22 11:34:29InfoGripe aponta tendência de crescimento da Covid-19 em todos os estados https://amazonia.fiocruz.br/wp-content/uploads/2021/03/centro-de-estudos_19032021_TopoMateria.jpg
376
820
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2021-03-17 16:36:102021-03-19 10:39:51Centro de Estudos da Fiocruz Amazônia vai abordar marcadores para o desenvolvimento de produto e ciência básica
https://amazonia.fiocruz.br/wp-content/uploads/2021/03/centro-de-estudos_19032021_TopoMateria.jpg
376
820
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2021-03-17 16:36:102021-03-19 10:39:51Centro de Estudos da Fiocruz Amazônia vai abordar marcadores para o desenvolvimento de produto e ciência básica https://amazonia.fiocruz.br/wp-content/uploads/2021/03/foto-3-Abertura.png
583
1006
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2021-03-16 07:23:012021-03-17 22:52:14Aula inaugural da Fiocruz Amazônia aborda pandemia de Covid-19 no Brasil e na Amazônia
https://amazonia.fiocruz.br/wp-content/uploads/2021/03/foto-3-Abertura.png
583
1006
Carlos Gomes
https://amazonia.fiocruz.br/wp-content/uploads/2024/06/Assinatura-conjunta-2024-ILMD-Fiocruz-SUS_branca-1.png
Carlos Gomes2021-03-16 07:23:012021-03-17 22:52:14Aula inaugural da Fiocruz Amazônia aborda pandemia de Covid-19 no Brasil e na Amazônia
Fiocruz recebe primeiro registro da Anvisa para vacina Covid-19 produzida no Brasil
A Agência Nacional de Vigilância Sanitária (Anvisa) concedeu o registro definitivo da vacina Covid-19 Fiocruz...

Fiocruz Amazônia abre inscrições para o Curso de Atualização em Boas Práticas Laboratoriais
O Instituto Leônidas & Maria Deane (ILMD/Fiocruz Amazônia)…

Cinco cidades apresentam resultados positivos com o uso de Estações Disseminadoras de Larvicida para o controle de Aedes
Representantes das secretarias de saúde dos municípios de Parintins,…

Segurança e apoio ao gerenciamento de projetos foram pautas do Conselho Deliberativo da Fiocruz Amazônia
Conselheiros, pesquisadores, bolsistas e demais colaboradores…

Palestra sobre empreendedorismo e café de negócios marcam 3º Workshop de Inovação
Palestra com foco no empreendedorismo e um café de negócios…

Fiocruz Amazônia participa de Seminário Nacional sobre Violência e Saúde na Fiocruz Ceará e alerta para as repercussões dos diferentes tipos de violência sobre a juventude
Evento é parte das atividades presenciais do Programa Institucional de Articulação Intersetorial Violência e Saúde (PI-AIVS), da Fiocruz, iniciado em 2022, pelo ILMD/Fiocruz Amazônia, com a realização, em Manaus, do Seminário “Violência e Saúde em Tempos de Emergências Sanitárias Globais

Pesquisadores da Universidade de Oxford visitam a Fiocruz Amazônia
Objetivo é estreitar as relações com a unidade, especialmente o Núcleo de Vigilância de Vírus Emergentes, Reemergentes ou Negligenciados, responsável pelas pesquisas de vigilância genômica de vírus e patógenos

Fiocruz Amazônia é tema de painel da XIV Semana Acadêmica do Instituto de Ciências Biológicas da UFAM
Alunos de Ciências Biológicas e Ciências Naturais participaram da palestra sobre o tema "Oportunidades de Atuação na Fiocruz Amazônia"
